您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-12-12 12:45
生物安全柜一般由柜体、风机、集液槽、过滤器、照明灯、控制面板、支撑脚及脚轮组成。
本文适用于YY0569所定义的Ⅱ级生物安全柜产品(以下简称生物安全柜)。
生物安全柜在《医疗器械分类目录》(国家食品药品监督管理总局公告2017年第104号)中的分类编码为22-16-01,按第三类医疗器械管理。
生物安全柜的功能包括但不限于:风速控制(包括风速稳定性等)、监测和报警、联锁系统(包括对外排风机等外部设备提供联动控制信号)、过滤器过滤效率等。
气流模式图、结构图示例如下(图1-图4):
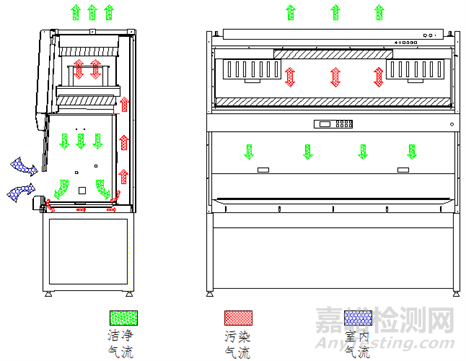
图1 A2型生物安全柜气流模式图
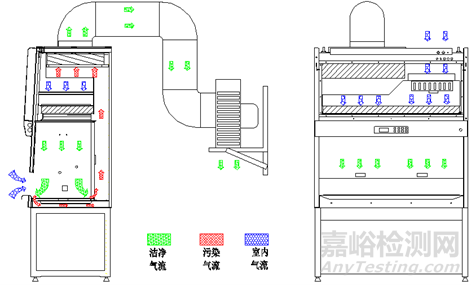
图2 B2型生物安全柜气流模式图
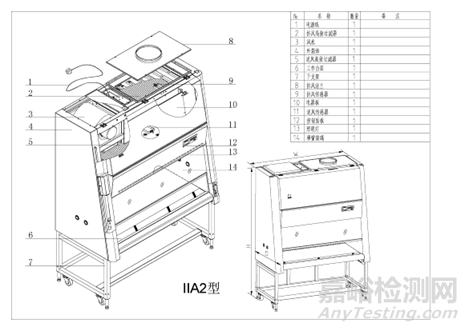
图3 A2型生物安全柜结构示意图
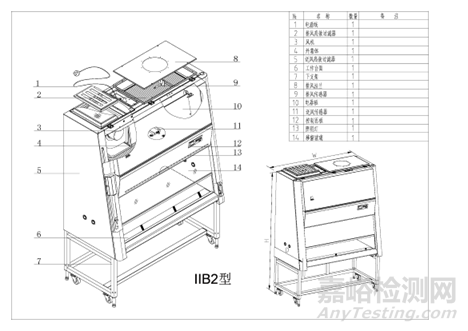
图4 B2型生物安全柜结构示意图
一、生物安全柜适用的标准
GB 4793.1《测量、控制和实验室用电气设备的安全要求第1部分:安全通用要求》
GB/T 18268.1 《测量、控制和实验室用的电设备电磁兼容性要求第1部分:通用要求》
GB/T 14710《医用电气设备环境要求及试验方法》
YY 0569《II级生物安全柜》
二、生物安全柜性能研究实验要求
检测时应选取能够代表本注册单元内其他型号的电气安全性能的规格型号。
一般来讲,同一注册单元的不同型号规格的产品具有不同的柜体规格和结构,这些差异在YY0569中各项功能性能的表现上不具有典型性。开发人应验证所有型号规格产品的YY0569符合性。
若生物安全柜除基本部件外还配置了其他附件,如显示操作模块、挂杆等(后文均简称附件),检测应考虑附件配置前、后的情况。柜内配置的附件对气流可能产生影响的,配置附件不同的型号之间没有典型性。应视实际情况选择YY0569中受影响的条款进行检测。
存在多个型号过滤器、风机的,均应进行相关验证。
1.化学和物理性能研究
明确产品的各项技术参数,如有可调节参数或监测参数,应测试确定参数的调节或监测(包括显示)范围及误差。
如适用的国家标准、行业标准中有不适用的条款,应明确不适用的条款及其理由。
对于配置了附件的生物安全柜,应明确附件的安装位置及安装方式,并验证其对安全、有效性的影响。验证时应考虑在正常使用中可能的最不利的配置情况,包括附件本身,以及由于附件的配置,带来的其他物品的连接、悬挂,验证项目应包括但不限于:物品数量、位置以及相关的人员操作对气流的影响;长期使用后安装部位老化导致的泄漏等。
应按照GB/T14710中气候环境I组和机械环境I组及表1的规定,开展相关研究。
表1 环境试验项目
|
试验项目 |
试验要求 |
检测项目 |
|||||||
|
持续 时间 h |
恢复 时间 h |
通电 状态 |
试验 条件 |
初始 检测 |
中间 检测 |
最后 检测 |
电源电压 V |
||
|
198 |
242 |
||||||||
|
额定工作 低温试验 |
1 |
— |
试验时 通电 |
正常试验条件 |
全性能 |
— |
a |
√ |
— |
|
低温贮存 试验 |
4 |
8 |
试验后 通电 |
正常试验条件 |
— |
— |
a |
220 |
|
|
额定工作 高温试验 |
1 |
— |
试验时 通电 |
正常试验条件 |
— |
a |
— |
— |
√ |
|
运行试验 |
4 |
— |
试验时 通电 |
正常试验条件 |
— |
— |
a |
— |
√ |
|
高温贮存 试验 |
4 |
4 |
试验后 通电 |
正常试验条件 |
— |
— |
a |
220 |
|
|
额定工作 湿热试验 |
4 |
— |
试验时 通电 |
正常试验条件 |
— |
— |
a |
220 |
|
|
湿热贮存 试验 |
48 |
24 |
试验后 通电 |
正常试验条件 |
— |
— |
a |
220 |
|
|
运输试验 |
— |
试验后 通电 |
正常试验条件 |
— |
— |
全性能 |
220 |
||
|
备注 |
1、“—”表示不作要求。低温储存试验中的低温为-40℃ 2、a表示YY0569的5.4.7、5.4.8条款 |
||||||||
2.软件研究
生物安全柜的软件属于软件组件,一般用来控制生物安全柜的运行及报警,一旦软件失效,可能造成环境及实验样品的污染,并给人员带来严重伤害,甚至死亡,因此其软件安全性级别应归为严重(C级)。
应依据《医疗器械软件注册技术审查指导原则》建立医疗器械软件描述文档。如适用,应依据《医疗器械网络安全注册技术审查指导原则》建立网络安全描述文档。
3.清洁、消毒研究
可采用YY0569附录B提供的方法,明确消毒工艺(方法和参数)以及确定消毒方法。应对消毒效果以及产品材料(包括工作区、集液槽、整流网板等区域的材料)的耐消毒剂腐蚀性进行验证。
4.稳定性研究
依据《有源医疗器械使用期限注册技术审查指导原则》的要求明确产品使用期限并进行验证。确定产品正确运输的环境条件,开展在宣称的运输条件下,保持包装完整性的验证,可包括抗压(堆码)、振动、运输等试验。
5.其他研究
生物安全柜属于免于进行临床评价的医疗器械,开发人应按照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》的要求开展相关研究。
三、产品风险管理资料
风险管理资料关注点如下表2:
表2
|
危险(源)分类 |
危险(源)二级分类 |
危险(源)示例 |
|---|---|---|
|
能量危险(源) |
电磁能 |
网电源 |
|
漏电流(外壳漏电流、对地漏电流、患者漏电流) |
||
|
辐射能 |
紫外线辐射 |
|
|
机械能 |
稳定性 |
|
|
振动 |
||
|
噪声:风机运行时产生的噪音 |
||
|
热能 |
风机发热,温度上升 |
|
|
照明发热,接触烫伤 |
||
|
生物学和化学危险(源) |
生物学 |
微生物:不定期消毒有可能导致工作区细菌滋生,污染样品的危险。 |
|
操作危险(源) |
功能 |
报警异常 |
|
传感器故障(包括风速传感器、温度传感器和位置传感器等) |
||
|
风速异常 |
||
|
操作界面异常(黑屏、按键失灵等) |
||
|
风机老化 |
||
|
操作危险(源) |
使用错误 |
生物安全柜模式或参数设置不当 |
|
清洗消毒不及时 |
||
|
杂物堆积,灰尘积累过多,未及时清洗 |
||
|
过滤器的使用寿命,堵塞或泄露造成的危险 |
||
|
信息危险(源) |
标记和说明 |
使用说明书不完整 |
|
性能指标描述不充分 |
||
|
预期用途规定不充分 |
||
|
使用限制条件说明不充分 |
||
|
使用前检查规定不充分 |
||
|
操作指示过于复杂 |
||
|
警告 |
开启紫外灯时,对人辐射的危险 |
|
|
接入电源没有良好接地的危险 |
||
|
其他关于安全使用生物安全柜的警告 |
||
|
服务和维护规程 |
服务和维护周期定义不当 |

来源:嘉峪检测网


