您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-02-23 13:35
本文适用于由GB/T 4240中规定的30Cr13、40Cr13、12Cr18Ni9、06Cr19Ni10牌号不锈钢材料制造,用于缝合内脏、软组织、皮肤等的缝合针,为一次性使用。
根据《医疗器械分类目录》,产品分类编码为02-07-01。
一、缝合针结构组成与工作原理
缝合针由针尖、针体、针尾组成(见图1),该产品一般一次性使用。
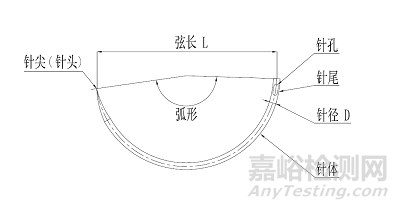
图1 缝合针示意图
按针的形式、弧形、针孔不同分为若干型式,每种型式按直径、弦长、针长的不同分为不同规格。
根据形式划分:圆针、三角针(正三角、反三角、短刃三角、半弯、三角半弯等)、铲针、钝针、钻石针等。部分形式示例见图2。


圆针 钝针


正三角针 反三角针


钻石针 铲针
图2 形式示例图
根据弧形划分:直形、1/4弧、3/8弧、1/2弧、5/8弧等。部分弧形示例见图3。
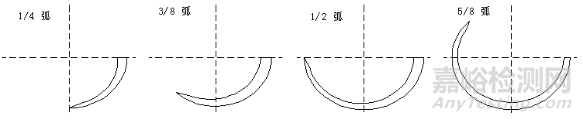
图3 弧形示例图
根据针孔划分:普通孔、无眼针、弹机孔。针孔示例见图4。
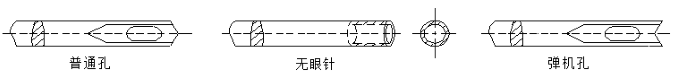
图4 针孔示例图
缝合针的形式、弧形、针孔和规格建议用下列方法表示:
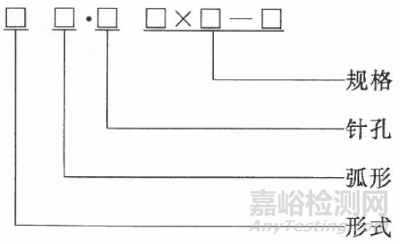
其中:
1)形式,用文字和/或符号标示如下:
圆或“○”;正三角或“△”;反三角或“▽”;短刃三角或“短刃△”;半弯;三角半弯或“△半弯”; 铲形或“  ”;钝针;钻石。
”;钝针;钻石。
2)弧形,标示如下:
直形、1/4弧、1/2弧、3/8弧、5/8弧。
3)针孔,以代号标示如下:
A(可省略)——表示普通孔、无眼针;
B ——表示弹机孔。
4)规格,表示如下:
直径×弦长,或,直径×弦长—针长。
(直径以标示值×10表示)
示例:
直径D=0.7mm,弦长L=24mm,针长=31mm,针孔为普通孔,形式为圆针,弧形为3/8弧,标示为:
圆3/8弧·7×24,或,圆3/8弧·7×24—31;
○3/8弧·7×24,或,○3/8弧·7×24—31。
通过锋利的针尖结构进行穿刺、切割,经过针体的平滑过渡,引导缝合线进行缝合。
二、缝合针主要风险
根据YY/T 0316附录E,缝合针产品可能涉及的危险(源)如表1所示,还应根据自身产品特点确定其他危险(源)。
表 1 危险(源)、可预见的事件序列、危险情况和可发生的伤害之间的关系示例
|
危险(源) |
可预见的事件序列 |
危险情况 |
伤害 |
|
物理危险(源)
|
缝合针在使用过程中由于韧性不够或夹持位置不正确等原因造成断针 |
断针 |
断针留在患者体内,延误治疗,威胁患者生命安全 |
|
刺穿力、切割力不足 |
使用过程中不易穿刺及不利于引导缝合线 |
延误治疗或手术失败 |
|
|
硬度不够 |
变形 |
延误治疗或产品无法使用 |
|
|
产品被重复使用 |
产品物理性能下降 |
延误治疗或手术失败 |
|
|
化学危险(源) |
原材料不合格,易腐蚀生锈或易断 |
不合格材料和患者直接接触 |
产生刺激过敏等症状或断针留在患者体内,威胁患者生命安全 |
|
对生产加工过程使用的所有辅剂、助剂等添加剂残留量的控制未能按标准确认,或未能按确认的结果实施控制,致使添加剂残留超标 |
超量的添加剂进入人体 |
损坏创面愈合,危害患者康复安全,二次手术 |
|
|
对环氧乙烷残留量的控制未能按标准确认,或未能按确认的结果实施控制,解析不彻底,致使环氧乙烷残留量超标 |
超量的环氧乙烷进入人体 |
损坏创面愈合,危害患者康复安全,二次手术 |
|
|
未能按运输、储存要求对产品实施防护,造成产品包装破损,产品被污染 |
患者使用不合格产品 |
造成感染和/或交叉感染;导致患者刺激过敏、炎症、休克、严重时致死 |
|
|
生物学危险(源) |
使用生物不相容的材料 |
生物不相容材料与患者直接接触 |
导致患者刺激过敏、炎症、休克、严重时致死 |
|
灭菌工艺未得到确认或未按已确定的工艺实施灭菌 |
不合格产品与患者直接接触 |
导致患者刺激过敏、炎症、休克、严重时致死 |
|
|
超过灭菌有效期的产品带菌 |
不合格产品与患者直接接触 |
导致患者刺激过敏、炎症、休克、严重时致死 |
|
|
在产品规定的有效期前,包装材料老化不能保持无菌水平 |
不合格产品与患者直接接触 |
导致患者刺激过敏、炎症、休克、严重时致死 |
|
|
产品被重复使用 |
患者使用有菌产品 |
导致患者刺激过敏、炎症、休克、严重时致死 |
|
|
产品使用完未按医疗垃圾处理 |
有菌或有毒物质影响环境 |
造成患者或医护人员之间的感染和/或交叉感染;威胁患者或医护人员人身安全 |
|
|
操作危险(源) |
不具备产品使用资质的人员使用产品,操作不当 |
错误使用产品 |
导致产品断裂、细菌污染、延误治疗、威胁患者生命安全 |
|
信息危险(源) |
外部和内部标记不全面、标记不正确或不能够清楚易认,标识位置不恰当,以及标识不能够永久贴牢 |
操作人员不能正确使用产品 |
产品失效或人员受伤;型号规格选用错误缝合失败、造成刺激过敏、炎症、休克、严重时致死 |
|
说明书缺少必要的警告说明和详细的使用方法或缺少详细的日常使用维护规范;说明书中有关维护、保养等内容不明确 |
操作人员不能正确使用产品 |
延误治疗或手术失败 |
三、缝合针性能研究实验要求
缝合针的基本技术性能指标主要参照YY/T 0043《医用缝合针》。常见的技术指标包括但不限于以下内容:
(1)外观:针体,三角刃口,表面粗糙度,弹机孔嵌线(如适用);
(2)物理性能:硬度,弹性,韧性,针尖强度(弦长L≥12mm的缝合针适用);
(3)使用性能:刺穿力,切割力;
(4)初始污染菌(如适用) ;
(5)耐腐蚀性能;
(6)灭菌(如适用) ;
(7)环氧乙烷残留(如适用)。
1、物理和化学性能研究
应当开展产品性能研究以及产品技术要求的研究,明确包括功能性、安全性指标以及与质量控制相关的其他指标,明确所采用的标准或方法、采用原因及理论基础。
对于YY/T 0043中未涵盖的针型,应结合产品特点和预期缝合部位特征,制定其适用的性能指标,如硬度、刺穿力、切割力等指标。
产品的检验方法应根据技术性能指标设定,检验方法应优先采用公认的或已颁布的标准检验方法,如果没有现行的标准检验方法可采用时,规定的检验方法应具有可操作性和可重现性,需要时明确样品的制备方法。
2、生物相容性评价研究
应参照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》对成品(主要考虑与患者和使用者直接或间接接触的材料)的生物相容性进行评价。生物相容性评价研究应当包括:明确生物相容性评价的依据和方法,明确产品所用材料及与人体接触的性质,实施或豁免生物学试验的理由和论证,对于现有数据或试验结果的评价。
生物学评价过程中应当注重运用已有信息(包括材料、文献资料、体外和体内试验数据、临床经验),当生物学评价确定需要进行生物学试验时,应至少符合YY/T 0043以下要求:细胞毒性试验反应不大于1级;迟发型超敏反应应不大于1级;皮内反应计分应不大于1。
3、灭菌工艺研究
3.1生产企业灭菌:应明确灭菌工艺(方法和参数)和无菌保证水平(SAL),并进行灭菌确认。器械的灭菌应通过GB 18279.1、GB/T 18279.2或GB 18280.1、GB 18280.2、GB/T 18280.3确认并进行常规控制,无菌保证水平(SAL)应保证达到1×10-6。
3.2终端用户灭菌:应当明确推荐的灭菌工艺(方法和参数)及所推荐的灭菌方法确定的依据。终端用户灭菌的缝合针无菌保证水平(SAL)也应达到1×10-6。
3.3残留毒性:若灭菌使用的方法容易出现残留,如采用环氧乙烷灭菌,应当开展研究明确残留物信息及处理方法,需开展研究保证产品出厂时环氧乙烷残留量不得大于10μg/g的处理方法。
3.4微生物控制:通过控制生产环境和生产过程保证初始污染菌水平。若缝合针非灭菌提供,其初始污染菌应小于等于100 CFU/件;且应当开展证明包装能减少产品受到微生物污染的风险,且适用于生产企业规定灭菌方法的研究。
3.5灭菌过程的选择应至少考虑以下因素:产品与灭菌过程间的适应性;包装材料与灭菌过程的适应性、灭菌对产品安全有效性的影响等。
4、产品货架有效期和包装研究
4.1货架有效期包括产品有效期和包装有效期。产品有效期验证可采用实时老化或加速老化的研究。加速老化试验研究的具体要求可参考YY/T 0681.1,应遵循极限试验等原则。在进行加速老化试验研究时应注意:产品选择的环境条件的老化机制应与宣称的运输储存真实条件下发生产品老化的机制相匹配一致。
对于包装的有效期验证,建议对在选择恰当的材料和包装结构合格后的最终成品包装的初始完整性和维持完整性进行检测。
4.2包装及包装完整性:在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料的毒理学特性;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与使用者使用时的要求(如无菌开启)的适应性;包装材料与标签系统的适应性;包装材料与正常贮存运输途径和过程的适合性。可参考GB/T 19633、YY/T 0681系列标准等。
5、其他研究
证明产品安全性、有效性的其他研究。

来源:嘉峪检测网


