今日头条
和黄医药VEGFR抑制剂美国报产。和黄医药宣布已完成向FDA滚动提交VEGFR抑制剂呋喹替尼的新药上市申请,用于治疗难治性转移性结直肠癌。在全球III期试验 (MRCT) FRESCO-2研究中,与安慰剂相比,呋喹替尼治疗组的mOS延长2.6个月,mPFS延长1.9个月。在中国,该新药已于2018年获批上市,用于治疗结直肠癌;并于2020年纳入医保目录。
国内药讯
1.三生国健预充式「益赛普」水针剂获批上市。三生国健研发的重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液获国家药监局批准上市。这是一款预充式益赛普水针剂(301S),它通过与TNF-α结合,抑制TNF-α的生物学活性,从而达到治疗效果。患者可以在家中自行注射,适用于活动性强直性脊柱炎、中重度活动性类风湿关节炎和中重度斑块状银屑病的治疗。该产品的原研厂家为安进/辉瑞,原研产品:恩利(Enbrel,依那西普)。
2.华东医药利拉鲁肽获批上市。华东医药旗下中美华东申报的利拉鲁肽注射液(利鲁平®)获国家药监局批准上市,用于成人2型糖尿病患者控制血糖。这是一款GLP-1受体激动剂,是诺和诺德利拉鲁肽(诺和力®)的生物类似药,规格为3ml(18mg,预填充注射笔/笔芯)。除糖尿病适应症外,该新药用于肥胖或超重适应症的上市许可申请已获得CDE受理。
3.辉瑞PARP抑制剂中国报产。辉瑞甲苯磺酸他拉唑帕利胶囊(talazoparib)的2.4类化药上市申请获国家药监局受理。Talazoparib(Talzenna)是一款口服多聚ADP-核糖聚合酶(PARP)抑制剂,已于2018年获得FDA批准上市,用于治疗BRCA突变(gBRCAm)、HER2阴性局部晚期或转移性乳腺癌。根据中国药物临床试验登记与信息公示平台,该新药目前正与恩扎卢胺开展联合治疗转移性去势敏感性前列腺癌(mCSPC)的国际Ⅲ期研究。
4.强生FIC双抗拟纳入突破性疗法。强生靶向GPRC5D/CD3的潜在“first-in-class”双抗Talquetamab获CDE拟纳入突破性治疗品种,用于治疗接受过至少3种治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38抗体)的复发或难治性多发性骨髓瘤(RRMM)成人患者。在Ⅰ/Ⅱ期MonumenTAL-1试验中,中位随访为14.9个月时,talquetamab(0.4mg/kg QW)的总缓解率达到74.1%,非常好的部分缓解率为59.4%。此前,FDA已授予Talquetamab治疗R/R MM的突破性疗法资格和孤儿药资格。
5.科士华TCR-T细胞疗法获孤儿药资格。科士华生物KSH01 HD-TCR T细胞疗法获FDA授予孤儿药资格。该公司利用其核心技术平台TCR-XFinder及TCR-XPlanet T细胞数据库,能够从患者体内快速筛选出的具有强效抗肿瘤活性的天然来源TCR序列;使得候选产品在保证与抗原的高亲和力结合的前提下,又避免人工序列优化带来的严重脱靶毒性。该新药拟开发用于食管癌、胃癌、黑色素瘤、肉瘤等多种晚期实体瘤的治疗。
6.丹诺医药多靶点偶联分子Ⅱ期临床积极。丹诺医药多靶点偶联分子TNP-2092胶囊治疗肝硬化高氨血症/肝性脑病的Ⅱ期临床结果积极。数据显示,与安慰剂相比,600毫克TNP-2092治疗组的血氨较基线下降数值、恢复正常的比例和血氨较基线下降比例,均具有统计学显著差异;药物总体耐受性良好。在美国,TNP-2092已获得FDA的合格传染病产品资格、快速通道和孤儿药资格认定。
国际药讯
1.K药获FDA批准治疗不限癌种实体瘤。默沙东PD-1单抗帕博利珠单抗(Keytruda)获FDA从加速批准转为完全批准,用于经FDA批准的检测方法确定的不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤成人和儿童患者。3项试验汇总分析显示,Keytruda在这类实体瘤患者中的总缓解率(ORR)为33.3%;其中39%的患者应答持续时间为36个月或更长;中位缓解持续时间(DOR)为63.2个月。
2.O药新辅助治疗肺癌长期疗效积极。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)联合含铂化疗用于新辅助治疗可切除非小细胞肺癌的Ⅲ期临床(CheckMate-816)三年随访结果积极。中位随访为41.4个月时,Opdivo联合化疗较单独化疗使疾病复发、进展或死亡风险降低32%;两组的三年无事件生存率(EFS)分别为57%和43%(HR:0.68,95% CI:0.49-0.93),三年期生存率分别为78%和64%。随访期间没有新的安全性信号出现。
3.AD非侵入性神经调节设备Ⅱ期临床积极。Cognito Therapeutics公司非侵入性神经调节设备GammaSense刺激系统用于治疗阿尔茨海默病(AD)患者的Ⅱ期临床结果积极。GammaSense能够利用感觉刺激引起大脑中的伽马振荡。结果显示,与接受假刺激患者相比,在接受每天伽马频率光和声音刺激的GammaSense患者中观察到全脑体积损失显著的减少;患者的白质体积、枕叶体积和皮质厚度损失亦显著减少。该设备对淀粉样蛋白阳性和阴性受试者均有效,包括维持患者认知和功能疗效结局。
4.GLP受体双重激动剂启动减肥II期临床。Zealand公司开发的GLP-1R/GLP-2R双重激动剂dapiglutide(ZP7570)在clinicaltrials.gov网站上登记启动一项II期概念验证临床试验,拟入组54例18~75岁体重指数(BMI)≥30kg/m2的肥胖症患者,评估每周一次dapiglutide治疗的减重效果。Dapiglutide是目前唯一一款进入临床阶段的GLP-1R/GLP-2R双重激动剂。Dapiglutide在比格犬血浆中的半衰期约为35h,在人血浆中的半衰期约为120h。
5.礼来N3pG淀粉蛋白抗体早期临床积极。礼来在AD/PD 2023会议中公布其新一代N3pG淀粉样蛋白抗体remternetug(LY3372993)用于治疗阿尔茨海默病(AD)患者的Ⅰ期临床积极结果。数据显示,LY3372993能够剂量依赖性降低淀粉样蛋白水平。第169天,接受治疗的24例患者中有18例达到淀粉样蛋白清除。临床中,患者身上出现淀粉样蛋白相关成像异常(ARIA)类别的常见副作用,药物总体安全性可控。
6.Vertex与CRISPR基因编辑公司达成合作。Vertex公司宣布已与CRISPR Therapeutics达成一项新的非独家许可协议,将利用后者的基因编辑技术(CRISPR/Cas9)加速Vertex针对1型糖尿病(T1D)的低免疫细胞疗法的开发。根据协议,CRISPR Therapeutics将获得1亿美元预付款,高达2.3亿美元的研发里程金,以及合作产品的版税。此前,CRISPR和ViaCyte(已被Vertex收购)合作开发的异体、基因编辑、干细胞衍生的T1D候选产品已进入I/II期研究阶段。
医药热点
1.4月1日起新冠医疗费用报销转为常规。国家医保局等部门联合印发《关于进一步做好新冠患者医疗费用保障工作的通知》指出,自2023年4月1日起,以患者入院或就诊时间计算,调整新冠患者医保报销政策,将住院费用全额保障、门诊专项保障等特殊保障政策转为常规医疗保障政策,对参保患者符合规定的新冠医疗费用与其他乙类传染病实施相同的医保报销政策。基本医保、大病保险按规定支付后,个人负担仍然较重、符合医疗救助条件的,按规定给予分类救助。
2.国家妇产疾病临床医学研究中心上海分中心揭牌。4月1日,国家妇产疾病临床医学研究上海市分中心在同济大学附属第一妇婴保健院揭牌,旨在提高我国女性重大疾病的防治水平、妇产疾病风险管控能力及规范化诊疗能力。该中心将致力于建立妇产疾病临床研究协同创新网络平台,开展多中心大样本的临床研究,并促进科研成果的应用和临床转化。
3.王现坤任河北省卫生健康委员会主任。3月30日,河北省第十四届人民代表大会常务委员会第二次会议通过一批任免职人员名单。会议经表决,决定任命王现坤为河北省卫健委主任;决定免去杨猛的河北省卫健委主任职务。据公开信息,王现坤,男,汉族,1969年9月出生,大学,中共党员。曾任河北省邢台市委副书记,现任河北省卫健委党组书记,河北省卫健委主任。
评审动态
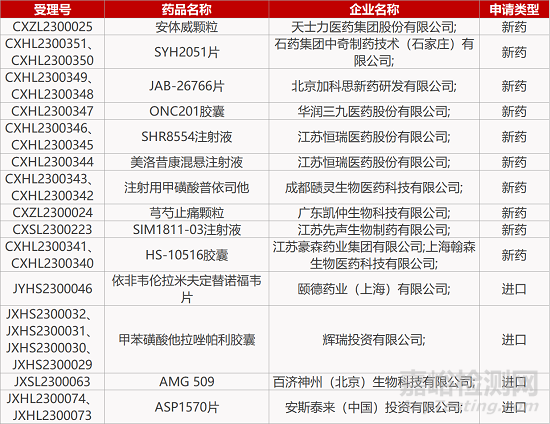
1. CDE新药受理情况(04月01日)
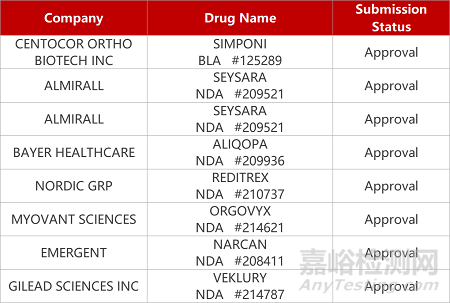
2. FDA新药获批情况(北美03月31日)