根据《医疗器械监督管理条例》规定,国家对医疗器械按照风险程度实行分类管理。进口及港澳台产品均由国家食品药品监督管理局管理。
一、如何确定医疗器械产品的类别?
1、网页查询:进入国家药监局网站---点击医疗器械标题栏---点击企业查询---点击医疗器械分类目录
2、查询文件:查询《医疗器械分类规则》或《医疗器械分类目录》(2017年第104号)
3、申请分类界定:境内产品向当地省局提交申请,进口产品向医疗器械标准管理研究所提交申请
4、同第三类申报:可直接按第三类医疗器械产品申报,器审中心根据申报产品的实际情况判定类别
5、创新、优先、药械组合:在申请完相应的流程后,可随即进行产品类别确定。
二、医疗器械分类规则?
(一)有关用语含义:
1、预期目的:指产品说明书、标签或者宣传资料载明的,使用医疗器械应当取得的作用。
2、无源医疗器械:不能依靠电能或者其他能源,但是可以通过由人体或者重力产生的能量,发挥其功能的医疗器械。
3、有源医疗器械:任何依靠电能或者其他能源,而不是直接由人体或者重力产生的能量,发挥其功能的医疗器械。
4、侵入器械:借助手术全部或者部分通过侵入人体,接触体内组织、血液循环系统、中枢神经系统等部位的医疗器械,包括介入手术中使用的器材、一次性使用无菌手术器械和暂时或短期留在人体内的器械等。
5、重复使用手术器械:用于手术进行切、割、钻、锯、抓、刮、钳、抽、夹等过程,不连接任何有源医疗器械,通过一定的处理可以重新使用的无源医疗器械。
6、植入器械:借助手术全部或者部分进入人体内或腔道(口)中,或者用于替代人体上皮表面或眼表面,并且在手术过程结束后留在人体内30日(含)以上或者被人体吸收的医疗器械。
7、接触人体器械:直接或间接接触患者或者能够进入患者体内的医疗器械。
8、使用时限:
1)连续使用:医疗器械按预期目的、不间断的实际作用时间;
2)暂时:医疗器械预期的连续使用时间在24小时以内;
3)短期:医疗器械预期的连续使用时间在24小时(含)以上、30日以内;
4)长期:医疗器械预期的连续使用时间在30日(含)以上。
9、皮肤:未受损的皮肤表面
10、腔道(口):口腔、鼻腔、食道、外耳道、直肠、阴道、尿道等人体自然腔道和永久性人造开口
11、创伤:各种致伤因素作用于人体所造成的组织结构完整性破坏或者功能障碍
12、组织:人体体内组织,包括骨、牙髓、或者牙本质,不包括血液循环系统和中枢神经系统。
13、血液循环系统:血管(毛细血管除外)、心脏
14、中枢神经系统:脑和脊髓
15、独立软件:具有一个或多个医疗目的,无需医疗器械硬件即可完成自身预期目的,运行于通用计算平台的软件。
16、具有计量测试功能的医疗器械:用于测定生理、病理、解剖参数,或者定量测定进出人体的能量或物质的医疗器械,其测量结果需要精确定量,并且该结果的准确性会对患者的健康和安全产生明显影响。
17、慢性创面:各种原因形成的长期不愈合创面,如静脉溃疡、动脉性溃疡、糖尿病性溃疡、创伤性溃疡、压力性溃疡等。
(二)医疗器械分类判定表
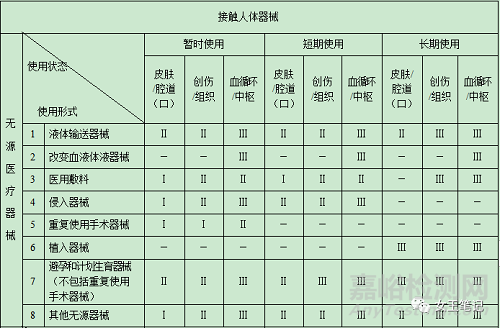

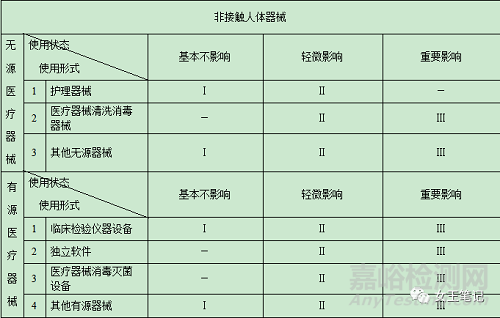
(三)有以下情形的,医疗器械分类时还应当参考下述原则:
1、如果同一医疗器械适用两个或两个以上的分类,应当采取其中风险程度最高的分类;由多个医疗器械组成的医疗器械包,其分类应当与包内风险程度最高的保持一致。
2、可作为附件的医疗器械,起分类应当综合考虑该附件对配套主体医疗器械的安全性、有效性的影响;如果附件对配套主体医疗器械有重要影响,福建的分类应不低于配套主体医疗器械的分类。
3、监控或者影响医疗器械主要功能的医疗器械,其分类应当与被监控、影响的医疗器械分类一致。
4、以医疗器械为主的药械组合产品,按照第三类医疗器械管理。
5、可被人体吸收的医疗器械,按照第三类医疗器械管理。
6、对医疗效果有重要影响的有源接触人体器械,按照第三类医疗器械管理。
7、医用敷料如果有以下情形,按照第三类医疗器械管理,包括:预期具有防组织或器官粘连功能,作为人工皮肤,接触真皮深层或其以下组织受损的创面,用于慢性创面,或者可被人体全部或部分吸收的。
8、以无菌形式提供的医疗器械,其分类不应低于第二类。
9、通过牵拉、撑开、扭转、压握、弯曲等作用方式,主动施加持续作用力于人体、可动态调整肢体固定位置的矫形器械(不包括仅具有固定、支撑作用的医疗器械,也不包括配合外科手术中进行临时矫形的医疗器械或者外科手术后或其他治疗中进行四肢矫形的医疗器械),其分类应不低于第二类。
10、具有计量测试功能的医疗器械,其分类应不低于第二类
11、如果医疗器械的预期目的是明确用于某种疾病的治疗,其分类应不低于第二类。
12、用于内窥镜下完成夹取、切割组织或者取石等手术操作的无源重复使用手术器械,按照第二类医疗器械管理。
13、体外诊断试剂按照有关规定分类
三、怎么申请分类界定?
(一) 适用于新研制的尚未列入《分类目录》或分类界定通知等文件的医疗器械是指在我国境内上市的全新产品; 或者与已上市的产品相比,产品的技术原理、结构组成、使用部位或技术特点、预期目的等发生了影响产品分类的实质性变化,根据《分类目录》或分类界定通知等相关文件难以确定管理类别的医疗器械。
(二)流程
1、申请人通过中国食品药品检定研究院(国家食品药品监督管理总局医疗器械标准管理中心)网站进入“医疗器械标准管理研究所”二级网站的“医疗器械分类界定信息系统”页面,注册后填写《分类界定申请表》,并上传其他申请材料。
在线打印《分类界定申请表》及其他上传的申请材料。加盖申请企业骑缝章,寄送至省级食品药品监督管理单位,进口及港澳台产品直接寄送至国家食品药品监督管理总局医疗器械标管中心(北京市大兴区生物医药产业基地华佗路31号院4号楼B104房间,编号:102629)。
由省级食药监管理部门负责对申请人提出的产品分类界定进行审查,经综合判定确定类别或提出预分类界定意见。
标管中心应当自其受理分类界定申请之日起20个工作日内完成类别确认工作。需要补充资料的,申请人应当在30个工作日内按照补正要求一次提供补充资料。补充资料及专家研讨所需时间不算在内。
(三)申请分类资料
1、分类界定申请表
2、产品照片和/或产品结构图
3、产品技术要求及产品说明书(样稿)
4、进口上市证明材料(如适用)
5、资料真实性自我保证声明
6、其他与产品分类界定有关的材料。其中对于尚未列入《分类目录》等文件的新研制产品,至少还应提交:
1)与国外已上市相关产品、《分类目录》或分类界定通知文件中相关产品的分析及对比,并说明符合新研制的尚未列入分类目录产品的判定依据。
2)核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述(如有)
3)产品的创新内容
4)信息或者专利机构出具的查新报告。
所申请资料应当使用中文。根据外文翻译的,应当同时提供原文。







