近日,国家药监局网站发布了八家医疗器械企业召回通告,其中涉及中国市场的只有三家企业,对于该三家企业的召回产品及批次均未在国内进口和销售,其他企业召回均不涉及中国地区。详细信息见文章附件。
通过召回信息的查看,我们关注到对于不同的情形召回级别不同,有三级召回、二级召回等区分,在召回报告中还需明确产品名称、注册证或备案凭证、涉及地区和国家、涉及产品批次和数量、召回原因、纠正行动等内容。
接下来带大家来回顾下医疗器械召回的法规要求,对于国内医疗器械产品的召回主要执行《医疗器械召回管理办法》。
医疗器械召回,是指医疗器械生产企业按照规定的程序对其已上市销售的某一类别、型号或者批次的存在缺陷的医疗器械产品,采取警示、检查、修理、重新标签、修改并完善说明书、软件更新、替换、收回、销毁等方式进行处理的行为。
2.医疗器械召回情形:
医疗器械召回有 主动召回、责令召回两种情形。
3.医疗器械召回缺陷:
召回所称的存在缺陷的医疗器械产品包括:
(一)正常使用情况下存在可能危及人体健康和生命安全的不合理风险的产品;
(二)不符合强制性标准、经注册或者备案的产品技术要求的产品;
(三)不符合医疗器械生产、经营质量管理有关规定导致可能存在不合理风险的产品;
(四)其他需要召回的产品。
4.召回的严重程度划分:
根据医疗器械缺陷的严重程度,医疗器械召回分为:
(一)一级召回:使用该医疗器械可能或者已经引起严重健康危害的;
(二)二级召回:使用该医疗器械可能或者已经引起暂时的或者可逆的健康危害的;
(三)三级召回:使用该医疗器械引起危害的可能性较小但仍需要召回的。
5. 召回时限的要求:
医疗器械生产企业作出医疗器械召回决定的,一级召回应当在1日内,二级召回应当在3日内,三级召回应当在7日内,通知到有关医疗器械经营企业、使用单位或者告知使用者。
附件:国家药监局网站召回通告。
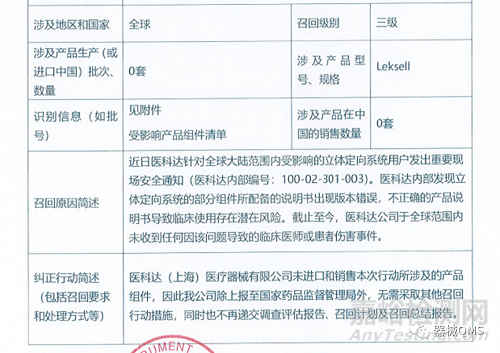
医科达(上海)医疗器械有限公司报告,由于部分组件所配备的说明书出现版本错误,生产商医科达(瑞典)医疗器械有限公司Elekta Instrument AB对立体定向系统(国械注进20142056130)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
沃芬医疗器械商贸(北京)有限公司报告,由于特定批次不符合当前标签上标示的24小时有效期的稳定性声明,生产商仪器实验室公司Instrumentation Laboratory Co.对活化的部分凝血活酶时间测定试剂盒(凝固法)HemosIL SynthAsil(国械注进20162404613)主动召回。召回级别为二级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
奥森多医疗器械贸易(中国)有限公司报告,由于在某些情况下MicroTip试剂包可能会因其开盖器组件的运行而损坏,生产商奥森多临床诊断(美国)股份有限公司Ortho-Clinical Diagnostics, Inc.对全自动生化免疫分析仪(国械注进20232220063)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。


赛诺龙(北京)医疗科技有限公司报告,由于可能存在特定批次Picoway设备的变焦手柄的镜片在组装过程中错误倒置的问题,生产商凯德朗公司Candela Corporation对Nd:YAG皮秒激光治疗仪PicoWay Laser system(国械注进20173092289, 国械注进20173242289)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
徕卡显微系统(上海)贸易有限公司报告,由于产品标签上显示了错误的有效期,生产商徕卡生物系统(纽卡斯尔)有限公司Leica Biosystems Newcastle Ltd对清洗液 Bond Wash Solution 10X Concentrate(国械备20150492)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
碧迪医疗器械(上海)有限公司报告,由于软件问题可能导致不正确的信息处理,生产商碧迪科斯化有限公司 BD Kiestra B.V.对全自动微生物样本处理系统 BD Kiestra™ InoqulA+™ TLA(国械备20220143)主动召回。召回级别为二级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
奥林巴斯贸易(上海)有限公司报告,由于电子气管插管内窥镜的510(K) 追加信息中的再处理参数与之前销售的电子气管插管内窥镜标签信息不一致,生产商奥林巴斯医疗株式会社对电子气管插管内窥镜(国械注进20183062428)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。
奥林巴斯贸易(上海)有限公司报告,由于部分地区发行的清洗消毒手册中错误地描述了4K摄像头可用高压方式灭菌,生产商奥林巴斯医疗株式会社对内窥镜摄像系统(国械注进20182220250)主动召回。召回级别为三级召回。涉及产品的型号、规格及批次等详细信息见《医疗器械召回事件报告表》。