您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-11 18:56
摘 要 / Abstract
2019 年新修订《药品管理法》明确全面实施药品上市许可持有人(MAH)制度。MAH 制度是新修订《药品管理法》确定的基本制度,也是核心制度,是贯穿整部《药品管理法》的一条主线。我国MAH 制度设计既接轨国际做法,又紧密贴合中国国情,释放了医药创新活力、优化了市场资源配置、夯实了主体责任、强化了监督管理,对于构建新时期药品监管制度体系、全面谱写中国式现代化药品监管新篇章意义深远。
The newly revised Drug Administration Law (2019) clearly stipulates the comprehensive implementation of the marketing authorization holder (MAH) system. The MAH system, as a fundamental and core framework defined in the revised law, serves as a central thread running through the legislation. The design of China's MAH system not only aligns with international practices but also closely reflects China's specific national circumstances. It has invigorated pharmaceutical innovation, optimized market resource allocation, strengthened accountability of primary entities, and enhanced supervision and regulation. This system holds profound significance for constructing a modern drug regulatory framework in the new era and for opening a new chapter in China's modernization of pharmaceutical regulation.
关 键 词 / Key words
药品上市许可持有人制度;委托生产;药品全生命周期管理;主体责任;创新激励
drug marketing authorization holder system; entrusted manufacturing; full lifecycle management of pharmaceuticals; primary responsibility; innovation incentives
从1984 年颁布《药品管理法》到2001 年修订《药品管理法》,我国一直实施的是药品上市许可与药品生产许可“捆绑”的管理制度,由药品生产企业持有药品品种。在我国市场经济秩序尚未完全建立、企业研制能力较弱的历史阶段,“捆绑”管理模式对于规范行业秩序、确立监管机制、保障药品供应具有一定的积极作用。随着我国市场经济体制逐步完善、药品生产管理水平不断提升、医药产业创新活力持续增强,既往“捆绑”模式不断受到挑战和考验[1]。药品上市许可和药品生产许可亟需分离,以解决药品研发动力不足、资源配置效率较低、药品全生命周期管理责任难以落实、相关主体责任不清等问题。
2015 年, 我国开始试点药品上市许可持有人(marketing authorization holder,MAH)制度。经过4 年试点探索,该制度于2019 年被正式写入《药品管理法》,成为贯穿全法始终的一条主线,也成为一项全国通行的法律制度。后续配套规章、规范性文件密集发布,具体细化MAH制度,逐步构建贴合中国国情的MAH 制度,完善新时期药品监管制度体系。自2015 年MAH 制度试点以来,改革已走过9 个年头,本文系统回顾MAH 制度发展历程,多方位展现制度成效,展望制度未来,以期推动MAH制度在不断完善中持续前行,进一步释放创新活力,优化资源配置,助推我国医药产业高质量发展。
1、我国MAH 制度的发展历程
1.1 试点期不断优化制度设计
根据《国务院关于改革药品医疗器械审评审批制度的意见》《全国人民代表大会常务委员会关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,国务院办公厅于2016 年6 月印发《药品上市许可持有人制度试点方案》(以下简称《试点方案》),MAH 制度试点工作在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川等10 个省(市)正式启动。根据《试点方案》要求,原国家食品药品监督管理总局于2016年7 月制定发布《总局关于做好药品上市许可持有人制度试点有关工作的通知》,明确试点工作程序,并鼓励符合条件的研发机构及科研人员等主体申报参加试点。随着试点工作的深入,为进一步探索MAH 的权利义务和法律责任,原国家食品药品监督管理总局于2017 年8 月制定发布《总局关于推进药品上市许可持有人制度试点工作有关事项的通知》,明确MAH 负责药品生产销售全链条和药品全生命周期管理,鼓励药品生产企业集团公司整合技术资源,促进专业化规模化生产,深入探索MAH 多点委托生产、委托销售药品运行模式等。后续《国家药品监督管理局关于药品上市许可持有人试点工作药品生产流通有关事宜的批复》《国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告》等系列文件的发布,进一步探索明晰了MAH 销售药品、直接报告不良反应等事项。2018 年10 月,为了更好地总结MAH 制度试点经验,为改革完善药品管理制度打好基础,并做好MAH制度试点工作和《药品管理法》修改工作的衔接,第十三届全国人民代表大会常务委员会第六次会议决定将MAH 制度试点工作的3 年期限延长1 年。
MAH 制度试点期间,通过将药品上市许可与生产许可分离、多种方式开展MAH 申报、开展MAH 委托生产及委托销售试点、探索患者损害救济制度、明晰MAH 全生命周期管理责任、创新跨省监管模式等多种做法,药品监管部门积极探索、积累MAH制度管理经验;4 年的试点探索也为后续MAH 制度全面实施奠定了坚实的基础。
1.2 全面实施中持续落实配套政策
2019 年8 月,伴随着新修订《药品管理法》审议通过,历经4年试点的MAH 制度正式从法律层面确立并于同年12 月1 日起实施。新修订《药品管理法》专设第三章“药品上市许可持有人”,对MAH 的定义,质量管理能力、风险防控能力、责任赔偿能力(以下简称三大能力)要求,关键责任人的要求,MAH 拥有的权益,境外MAH 的境内代理人管理等进行了规定,同时明确MAH 应当建立药品质量保证体系,加强委托生产、销售、储存、运输管理,建立药品上市放行规程,实施全过程追溯,建立药物警戒制度,开展上市后研究,建立年度报告制度,履行供应保障责任等。
新时期药品监管制度体系确定了以MAH 为核心、为抓手,落实全生命周期、全过程管理的基本理念。后续《药品注册管理办法》《药品生产监督管理办法》《药品经营和使用质量监督管理办法》等配套规章,以及《药物警戒质量管理规范》《药品年度报告管理规定》《药品召回管理办法》等配套规范性文件进一步细化了MAH 的资质要求、主体责任及其监督管理的规定。
例如, 针对MAH“ 三大能力”要求,《药品生产监督管理办法》从适应当前药品监管实践的角度,要求委托生产的MAH 也要取得《药品生产许可证》(B 类),后续各省份相继发布《药品生产许可证》(B. 委托生产的MAH)现场检查验收标准,细化对B 类药品生产许可证的验收要求。此外,国家药品监督管理局于2023年10 月发布《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》《国家药监局综合司关于印发药品上市许可持有人委托生产现场检查指南的通知》,再次重申MAH 应当设立职责清晰的管理部门,配备与药品生产经营规模相适应的管理人员,同时提出了对委托生产无菌药品、中药注射剂、多组分生化药等特殊品种的关键人员的资质要求,并严格开展B 类药品生产许可证的许可管理。
聚焦MAH 落实主体责任,国家药品监督管理局于2022 年12 月发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》,对MAH 全生命周期质量管理要求进行了抽提、整合与系统化,以指导督促MAH 尽职履责,依法落实质量安全主体责任。
围绕MAH 与受托方药品委托生产行为管理,国家药品监督管理局于2020 年10 月发布了《药品委托生产质量协议指南(2020年版)》《药品委托生产质量协议模板(2020 年版)》,指导、监督MAH 和受托生产企业履行药品质量保证义务。《药品上市许可持有人落实药品质量安全主体责任监督管理规定》《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》进一步细化和加强了MAH 委托生产质量管理及其监督管理。
2、我国MAH 制度试点、实践探索成效
MAH 制度试点的开展激发了医药行业创新活力、优化了医药行业资源配置、释放了多项政策红利。同时,MAH 制度实施成效也是近10 年来药品监管部门持续深化药品审评审批制度改革的一个生动缩影。
2.1 医药创新活力持续释放,创新药上市数量稳步增长
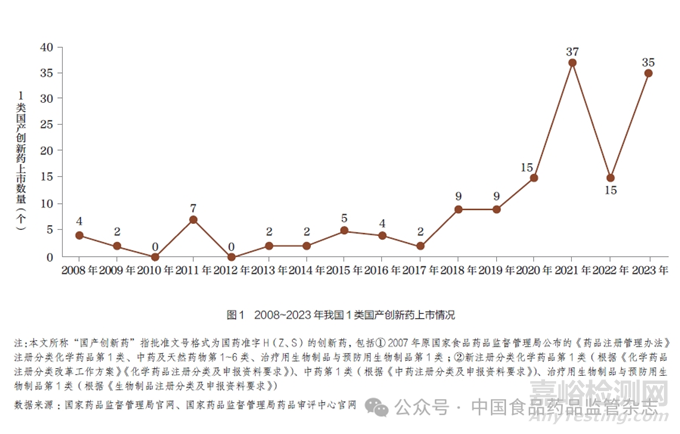
MAH 制度试点开展之前(2008~2015 年),我国共批准国产1 类创新药临床试验291 个(包括中药6 个、化学药品209 个、生物制品76 个),批准上市国产1 类创新药22 个(包括化学药品15 个、生物制品7 个)[2]。自MAH制度开展试点、全面实施以来, 我国国产创新药上市数量倍增, 进入快速发展通道。2016~2023 年, 以1 类化学药品计, 我国批准的新药临床试验(investigational new drug,IND) 申请数量逐年增长, 共批准2342 个, 环比增长率达1020.6%。获批上市的国产创新药共142 个(以通用名计),环比增长率达472.7%,其中1 类中药15 个、1 类化学药品71 个、1类预防用生物制品5 个、1 类治疗用生物制品35 个;其他包括3 类、5 类、6 类中药国产创新药12 个,抗COVID-19 国产创新预防用生物制品4 个。2008~2023 年我国1 类国产创新药上市情况具体见图1。
2.2 创新药委托生产普遍,行业重复建设有所减少
MAH 制度的核心是将药品上市许可和生产许可分离,药品研发机构或企业等可以通过委托生产、自主持有品种,并将产品推向市场,依法获得药品上市后的市场回报,即实现“轻资产”上市。由此,一方面降低新药创制成本,另一方面优化资源配置、减少重复建设,同时贯彻以人民为中心的发展思想,更好地满足患者用药需求。实践中,无论是MAH制度试点期间,还是全面实施以来,均有较多创新药通过本省份或跨省份委托生产的方式将产品推向市场,市场资源配置加速优化,行业重复建设有所减少。
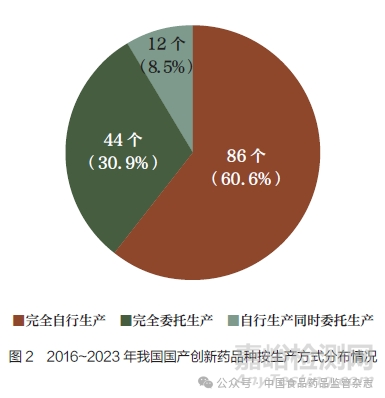
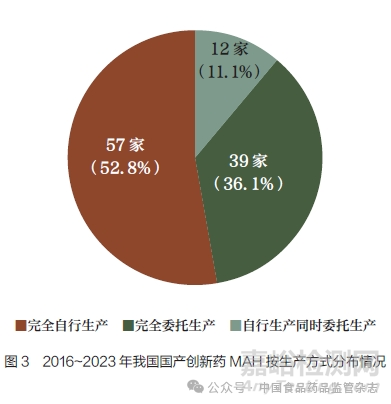
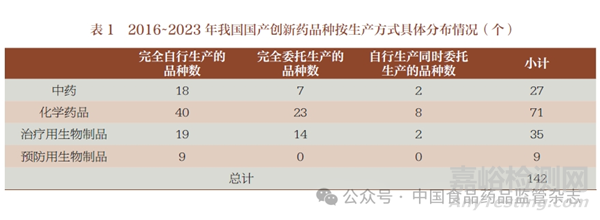
(1) 总体上:近40% 的国产创新药采用委托生产方式。2016~2023 年获批上市的142 个国产创新药中,有56 个采用委托生产方式(包括完全委托生产与自行生产同时委托生产情形,下同),占比近40%(图2)。其中,治疗用生物制品较多采用委托生产模式(16/35,45.7%);其次为化学药品(31/71,43.7%);中药有1/3 采用委托生产模式(9/27,33.3%);根据《疫苗管理法》相关规定,目前9 个预防用生物制品全部为完全自行生产(表1)。从MAH 角度来看,142 个国产创新药共涉及108 家MAH,其中采用委托生产方式持有国产创新药的有51 家(包括39 家完全委托生产的MAH 与12 家自行生产同时委托生产的MAH),占比接近一半(图3)。在完全采用委托生产的39 家MAH(共涉及42 个国产创新药)中,仅持有B证的有37 家(94.9%),同时持有A 证(自行生产)和B 证的1家,同时持有A 证、B 证和C 证(受托生产)的1 家。
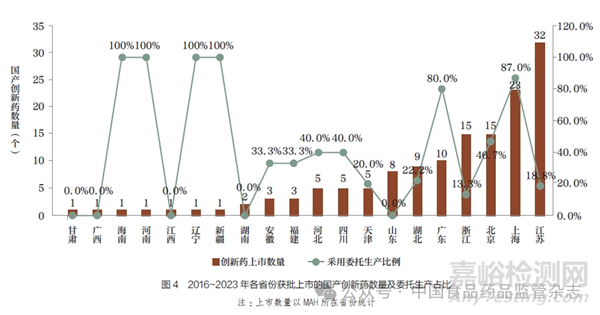
(2)分区域:北、上、广国产创新药委托生产占比更高。从地域分布看,2016~2023 年国产创新药上市数量排名前5 位的省份分别为:江苏(32 个)、上海(23 个)、北京(15 个)、浙江(15个)、广东(10 个)。其中,上海高达87.0%(20 个)的创新药采用委托生产模式上市,广东8个(80.0%)、北京7 个(46.7%)。以上35 个国产创新药中,有30个(85.7%) 由仅持有B 证的MAH 持有,充分体现出MAH 在激发创新活力、减少重复建设、提高现有产能利用率等方面的优势。此外, 新疆、辽宁、河南、海南虽均只有1 个国产创新药上市,但也通过整合资源,采用了委托生产方式。2016~2023 年各省份获批上市的国产创新药数量及委托生产占比情况具体见图4。
2.3 资源要素有序流动,市场活力不断增强
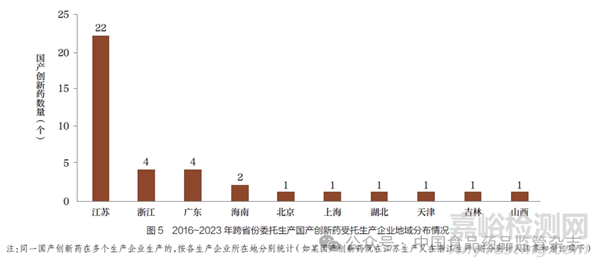
(1)跨省份委托生产普遍,江苏、浙江、广东为主要受托生产地。在上述56 个采用委托生产方式的国产创新药中,本省份委托生产的有23 个(41.1%);跨省份委托生产的有33 个(58.9%),占比更高。其中,江苏为跨省份委托生产中主要的受托生产企业所在省份,共涉及22个品种,远超其他省份;其次为浙江、广东,分别涉及4 个品种(图5)。
(2) 药品上市许可快速流转,市场价值得以体现。MAH 制度下,允许药品上市许可依法转让,并由受让方对转让后的药品质量承担责任,履行MAH 的义务。药品上市许可转让属于重大变更。根据《药品上市后变更管理办法(试行)》,药品转让过程中仅发生MAH 变更的,属于不需技术审评的审批事项,办理时限为20 个工作日。相关数据显示,现阶段药品上市许可转让呈持续增长趋势[3]。药品上市许可的流转有利于充分发挥批准文号的市场潜力,减少低水平重复申报,盘活市场资源。同时,监管部门在药品上市许可转让过程中也需要严格审核受让方的资质能力,重点关注长期停产品种恢复生产的工艺验证、药品生产质量管理规范(GMP)符合性等要求。
3、讨论与展望
MAH 制度对于鼓励创新、优化市场资源配置、减少重复建设、提升监管效能等具有非常重要的意义。但同时需要看到,MAH 制度带来的变化也给监管带来了诸多挑战。首先,较多B 类药品生产许可证持有人此前为研发企业、经营企业或其他类型的企业,存在质量意识薄弱、质量管理体系不健全、机构人员资质不符合、风险管控能力不足等问题[4]。其次,部分B 类药品生产许可证持有人与受托生产企业合作过程中,存在体系衔接困难、沟通有效性差等问题。最后,跨省份监管过程中存在标准不统一、部门间沟通不畅、缺乏监管信息大数据平台等挑战[5]。这些问题反映了当前我国正处于社会主义初级阶段,存在发展不平衡、不充分的情况,各地监管水平也存在一定的差异。目前,一方面监管部门需要持续引导、督促MAH 积极落实主体责任,不断建立健全全生命周期质量管理体系;同时受托方也应当严格遵守相关法规及合同约定,配合MAH 的审计和检查,及时汇报风险因素。另一方面,监管部门应当不断创新监管方式,利用人工智能等新技术、新手段赋能监管,构建监管大数据平台,实现监管信息共享;基于风险管理原则,依托药品安全信用档案和品种档案,加强对高风险企业、高风险品种的监督检查;强化行政指导,收集相关企业面临的现实问题,组织政策解读和法规培训等。
新时期MAH 制度的“四梁八柱”已经初步建立,需要坚持当前的发展方向,落实各方责任,创新监管机制方式方法, 推动MAH 制度行稳致远,更好地保障药品全生命周期质量安全,推动医药产业高质量发展,全面谱写中国式现代化药品监管新篇章。
引用本文
谢金平,杨伊凡,华焱钊,韩悦,邵蓉*.我国药品上市许可持有人制度试点、实践探索与未来展望[J].中国食品药品监管,2024(12):16-23.

来源:中国食品药品监管杂志


