召回是药企对风险产品进行的一种纠正,改进的一种方式。于FDA而言,则是维护患者生命健康安全的一道防线。召回既有自愿召回,也有强制召回。一般而言,企业更偏向于自愿召回,以防FDA采取更强硬的法律手段。
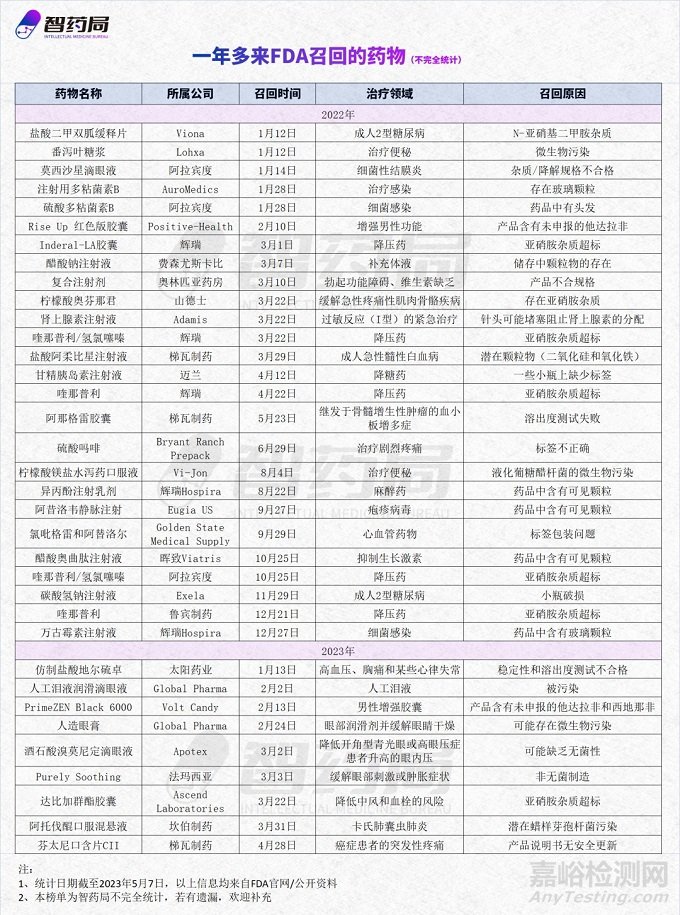
本文统计了近一年多来被FDA召回的35种药物(不完全统计),以此来分析召回的原因和近几年的趋势,希望对业内人士有所帮助。值得注意的是,被称为“仿制药神话”的印度,还是频频曝出质量门事件,引人深思。
1、整体概况
在智药局统计的35种召回药品中,2022年有26种,2023年至今有9种。
从治疗领域来看,召回药品种类多样,有治疗糖尿病、高血压、白血病等慢性病药品,也有治疗便秘、结膜炎、止痛药等常规药品。
其中,降压药和降糖药比重最高,各有6种和3种,召回主要原因都是因为致癌物亚硝胺杂质超标。
从所属公司来看,涉及多个国家,例如:美国的晖致和迈兰、以色列的梯瓦、瑞士的山德士、印度的太阳药业、阿拉宾度和鲁宾药业。
而这些公司,大多都处于全球仿制药巨头第一梯队。其中,以阿拉宾度为代表,近一年多来,至少有3起药品召回事件。
2、原因有五
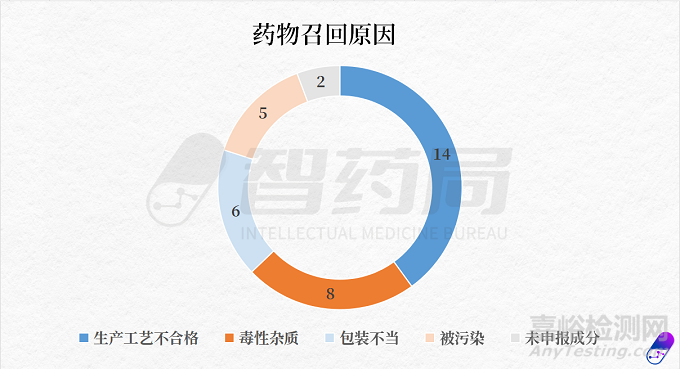
据智药局统计,近一年多来FDA召回药品(以上述表格为基础),原因多样,主要有五个:生产工艺不合格、含有毒性杂质、包装不当、被污染、未申报成分。
其中,因生产工艺不合格被召回事件次数最多,共有14起;其次是含有毒性杂质,共8起;包装不当排在第三位,共6起。
2.1 生产工艺不合格
生产工艺不合格包括在非无菌的环境下生产、药品中含有颗粒物、溶出度测试和稳定性测试不合格等情况。
例如,2022年3月29日,FDA发布公告,梯瓦制药自愿召回盐酸阿柔比星注射液USP 5 mg/5 mL ,原因是因为其内部检查发现在一小瓶产品中有颗粒物质,后被确定为二氧化硅和氧化铁。
含有颗粒物质的注射产品的给药可能会导致局部刺激或肿胀以响应异物,更严重的是可能会阻塞心脏、肺部或大脑中的血管,从而导致中风甚至死亡。
梯瓦制药表示,迄今为止尚未收到与该产品召回相关的不良事件的任何报告。
2.2 毒性杂质(以亚硝胺杂质为主)
自从2018年发生沙坦类药物因亚硝胺杂质污染而大面积召回的事件以来,亚硝胺杂质就成为了FDA近几年重点关注的内容。
基于此,2022年12月21日,鲁宾制药自愿召回了四批降血压药物喹那普利片剂,原因是因为亚硝胺杂质超标。
无独有偶,去年4月,辉瑞也自愿召回了五批Accupril品牌的喹那普利片剂。3 月召回了Accuretic品牌喹那普利/氢氯噻嗪和盐酸喹那普利/氢氯噻嗪的授权仿制药。
亚硝胺在水和食物中很常见,包括腌制和烤肉、乳制品和蔬菜。但如果人们长时间接触超过可接受的水平,则会增加患癌症的风险。
2.3包装不当
由于不当的给药指导,亦或随药品提供的给药工具出现问题,某种药品也会被召回。
最近的是今年4月28日,梯瓦制药自愿召回了芬太尼口含片 CII 的特定批次,因为这些产品的说明书中省略了安全更新。
不遵循或不知道药物指南中遗漏的安全更新,可能导致危及生命的不良事件。迄今为止,梯瓦尚未收到任何与产品标签相关的投诉。
去年,迈兰、Bryant Ranch Prepack和Exela也因为标签等包装问题,召回了降糖药和止痛药等药物。
2.4污染
微生物污染召回涉及多种药品,包括口服混悬液、软膏和滴眼液,涉及微生物种类的例子包括蜡样芽孢杆菌、剑兰伯克霍尔德菌和地衣芽孢杆菌等。这一趋势强调了在药物制造和储存中保持适当无菌和质量控制的重要性。
例如,因为存在微生物污染,Global Pharma,于今年2月2日和24日分别自愿召回了人工润滑剂滴眼液和人工眼膏。
图:人工润滑剂滴眼液
据FDA消息,就该人工润滑剂滴眼液,迄今为止,已有55起不良事件报告,包括眼部感染、永久性视力丧失和血流感染死亡。
2.5 未申报成分
近年来,药品中未申报成分一直是一个持续存在的问题,即未获得 FDA 事先批准以证明疗效和安全性的上市药物
例如,2023年2月13日,Volt Candy自愿召回一批 PrimeZen Black 6000,2000 毫克胶囊,因为它们含有未申报的他达拉非和西地那非。
含有西地那非和他达拉非的药物可能与某些处方药(如硝酸甘油)中的硝酸盐相互作用,并可能导致血压显着下降,从而危及生命,特别是使用硝酸盐治疗心脏病的成年男性。
去年2月,由于未申报的他达拉非,Positive-Health自愿召回了Rise Up 红色版胶囊。
3、再曝质量门事件
众所周知,印度被称为“仿制药神话”,据统计,其药品销往200多个国家,仿制药占全球仿制药总量的四成,出口总量占全球的两成。
但很早以前,因为质量门事件,印度多个仿制药巨头频上热搜,被多个欧美国家“红牌警告”。
如今看来,也未能幸免。
其中,就有印度仿制药巨头太阳药业,2018年5月,国家药监局发布公告,由于存在质量风险,自即日起在中国境内暂停销售印度太阳药业生产的注射用亚胺培南西司他丁钠。
而今年1月13日,太阳药业又陷入了一件召回事件中,其降血压药物仿制盐酸地尔硫卓,未通过FDA实验室的稳定性和溶出度测试,自愿召回,说白了还是质量问题。
无独有偶,印度仿制药另一巨头阿拉宾度,在2019年,就被FDA要求召回80多批批次的降压药物续沙坦,检测到的杂质N-亚硝基二乙胺超标。
在去年1月和10月,阿拉宾度又有三起药品召回事件,主要原因还是致癌物超标、降解规格不合格等质量问题。
上文我们还说到,因为亚硝胺杂质超标,印度鲁宾制药在去年12月自愿召回了4个批次的喹那普利/氢氯噻嗪片剂。
这并不是第一次,2021年10月FDA表示,鲁宾制药宣布召回其厄贝沙坦片和厄贝沙坦氢氯噻嗪片,原因也是因为致癌物n -亚硝基贝沙坦含量超标。
基于上,经常会有人说:仿制药行不通了......
对偷工减料和质量控制不佳的担忧,是过去几十年来印度制药工业低价崛起的长期负面印象。
未来能否扭转质量控制不力的名声,如今看来,路还很长。