来自阿斯利康(美国)和阿斯利康(瑞典)的创新药物研究及早期开发部门(IMED)的Dean G. Brown和Jonas Bostrom对药物化学研究中合成方法的过去和现在进行了比较分析。结果表明,现代药物化学(2014年)和三十年前(1984年)所应用的化学反应相比,现在应用最频繁的化学反应中没有一个是在过去二十年间发现的,仅有两个反应是在八十年代和九十年代发现的(Suzuki–Miyaura反应和Buchwald–Hartwig反应)。这表明新的合成反应对药物发现有较大的影响,其中应用最频繁的反应是酰胺键的形成、Suzuki–Miyaura偶联反应和SNAr反应,这主要取决于试剂的购买、高化学选择性等原因,这些应用的结果会导致某些类型的结构分子过多。
关于药物研究中应用的化学反应,Roughley 和Jordan曾发表了一篇重要文献(J. Med. Chem., 2011, 54, 3451-3479),详细分析了2008年来自于三大制药公司(GSK、Pfizer和AstraZeneca)的139篇论文中所应用的反应类型。排在前面的反应类型依次是:(a) 酰胺的形成(在所有反应中占16%);(b) 杂环的形成(7.4%);(c) N-芳基化(6.3%);(d) CO2H去保护(5.4%);(e) N-烷基化(5.3%);(f) 还原胺化(5.3%)和(g)N-Boc脱保护(4.9%)。虽然Roughley-Jordan文章和本篇文章应用的方法不同,但这两项研究中最常用反应的结果基本是一致的,而且过去三十年也大部分一致。
一、药物化学中应用最频繁的反应(1984 vs 2014)
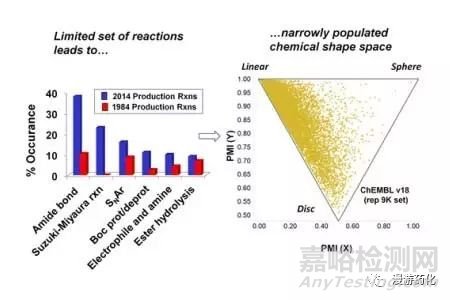
考察某反应在一系列文章中出现的频率,分析比较2014年和1984年的文献数据,结果显示了两个时期排在前20位的反应类型(图1)。2014年反应频率最高的前五位依次是:(a) 酰胺的形成,(b) SNAr反应,(c) Boc保护/去保护,(d) 酯水解反应,(e) Suzuki–Miyaura偶联反应。这些反应的发生频率和Roughley-Jordan文章里描述的是一致的。2014年文献中很多反应方案仅有较小的变化(如,酰胺缩合剂不同,保护/去保护的顺序不同等),综合考虑合成过程的差异性,则酰胺键的形成在2014年大多数文献(约50%)中至少出现一次。酰胺键的形成主要用于两大类,多肽合成(7.2%)和所有其他酰胺键偶联(50%,见图1)。如果结合这两大类,则酰胺键偶联反应在60%的2014年文献中至少出现一次。催化交叉偶联反应在药物化学中应用越来越广,其中最大类别是用钯催化的Suzuki–Miyaura偶联反应。最早的Suzuki文章发表在1981年,然而直到1984年才引起关注。
图1. 反应发生率. 至少在一篇文献中出现的比例(n=125,蓝色代表2014年J.Med.Chem.的数据,红色代表1984年J.Med.Chem.的数据)。箭头(和年)表示这个技术在原文献中第一次引用.
图中可以看到两个有趣的现象,其中酰胺键形成反应1984年为25%,2014年约为50%,而杂环合成在2014年要远低于1984年(24% vs 45%)。这反映出这些年试剂商业化的趋势,许多含官能团的杂环在1984年要制备,而2014年能买得到。另一个原因是高通量化学的发展,酰胺键反应比杂环合成更容易控制。另一个有趣的现象是Boc保护/去保护应用在1984年和2014年的相对比例,二碳酸二叔丁酯在1976年首次被介绍,1979-1980年Aldrich目录中将该试剂描述为“叔丁氧羰基的一个新试剂”。Boc保护基团的应用在当时不太容易被人接受,而现在已成为大家首选的氨基保护基团之一。
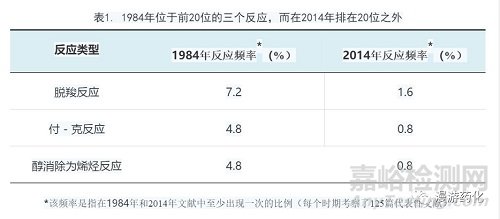
1984年大部分反应在2014年仍在应用,但三个反应除外(脱羧反应、付-克酰化和烷基化、醇消除为烯烃的反应)(表1)。这三个反应在1984年位于前20位,而在2014年已排在20位之外了,可能的原因是因为付-克类型的反应已经被交叉偶联反应或其他有机金属试剂所替代,而这些试剂在1984年是买不到的。烯烃的形成过去可能是通过消除反应来得到,现在可以通过其他方法得到(如,交叉复分解反应)。脱羧反应以前是形成C-C键优选方法的一个必须步骤(如,β-酮酸酯反应),但是现在被一些更有效和通用的过程所替代。
比较1984年和2014年化学反应的应用频率,得出的主要结论是:仅有少数的一些反应跌出前20位,少数反应被替代(如,Suzuki–Miyaura反应和Buchwald–Hartwig反应)。尽管在过去三十年间制药工业有很大变化,但1984年核心反应大部分仍然是2014年的核心反应。为什么其他新发展的合成反应没有进入前20位也值得我们思考。
二、药物化学中使用最频繁的终产物反应(1984 vs 2014)
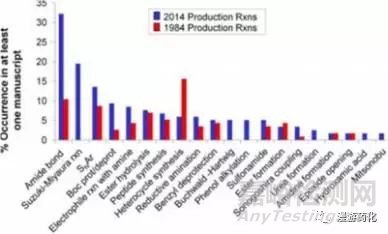
考察最后一步反应或称为“产物步骤”所应用的反应,2014年和1984年产物步骤的反应发生率见图2。现在应用而过去没有的一些新合成方法(如,Suzuki–Miyaura反应和Buchwald–Hartwig反应)在前面已经讨论过了。一个有趣的不同点是苯酚烷基化作为最后一步产物反应在1984年应用较少(0.1%),而在2014年有较大的增长(6%)。也有一些产物反应类型在1984年进入前20位,2014年则排出前20之外,如苯酚去甲基化反应和芳环的卤化反应,在1984年分别是7.8%和3.5%,而在2014年则都为0%。苯酚去甲基化反应在1984年较常见,一个可能的解释是因为在那个时代较多的靶标偏爱苯酚结构(如,雌激素体),因而苯酚会被选为终产物的一个官能团,而在2014年它则被认为是一个潜在的代谢原因,会引起葡萄糖苷化或形成活性代谢产物。
图2. 产物反应(或最后一步反应)的发生率. 至少在一篇文献中出现,代表性数据来自1984年(n=114) 和2014年(n=118) J.Med.Chem.的数据.
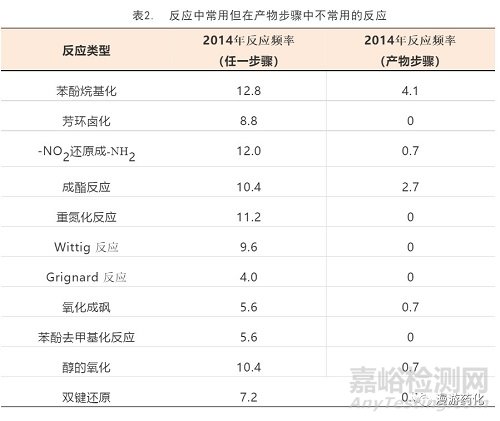
三、终产物步骤中很少应用的反应(2014年)
通过比较反应发生率(图1)和产物步骤反应发生率(图2),一些在产物步骤中不常被应用的反应要特别说明一下(表2)。现在一些反应在产物步骤中不常用的原因很明显,如,卤化反应会常常导致不期望的化学选择性,终产物卤化会产生一些多样性。在产物步骤中没有Grignard反应多少有些奇怪,尽管这个反应可以产生酮、醇、胺和其他不能由Suzuki–Miyaura反应得到的官能团。Grignard试剂虽然能购买但使用起来也不方便,因为它会带来后处理以及和质子溶剂交叉反应等问题,因此这些试剂在使用时常常要对一些基团进行保护。Wittig反应在终产物步骤中不被应用,是由于Wittig反应的终产物是烯烃,而烯烃作为官能团常被认为是非“药物友好”的,如,被怀疑会通过生物转化形成活性代谢物或具有光不稳定性。
参考文献:Dean G. Brown and Jonas Boström, J. Med.Chem., 2016, 59, 4443-4458.