今日头条
轩竹CDK4/6抑制剂报产。轩竹生物CDK4/6抑制剂1类化药吡罗西尼片的上市申请获国家药监局受理。今年4月,轩竹生物宣布该新药联合氟维司群治疗既往内分泌治疗后进展的HR+/HER2-晚期乳腺癌的III期临床达到主要研究终点,与对照组相比,吡罗西尼联合治疗具有显著的临床获益。值得一提的是,吡罗西尼联合醋酸阿比特龙和泼尼松治疗晚期或转移性前列腺癌的II期临床申请已获CDE受理。
国内药讯
1.正大天晴凝血因子VIII获批上市。正大天晴注射用重组人凝血因子VIII(商品名:安恒吉 )获国家药监局批准上市,用于预防12岁及以上血友病A患者(先天性凝血因子VIII缺乏)出血。关键临床结果显示,81例既往接受过人凝血因子VIII治疗的重度血友病A患者(≥12岁)接受安恒吉预防治疗,有48例患者未发生出血事件;大多数新发出血事件,可通过1次或2次输注止血。
2.映恩HER2-ADC启动Ⅲ期临床。映恩生物HER2 ADC药物DB-1303在Clinicaltrials.gov网站上注册一项Ⅲ期临床,拟评估用于HR+/HER2低表达的转移性乳腺癌患者的治疗效果与安全性。该项试验计划入组466例患者,预计2025年8月初步完成。今年4月,映恩生物已与BioNTech达成独家许可协议,授予BioNTech在全球(不包括中国大陆、香港和澳门地区)开发、生产及商业化两款ADC(DB-1303和DB-1311)的权利。
3.信达CD40L抗体获批自免病临床。信达生物1类生物制品IBI355的两项临床试验申请获国家药监局批准(受理号:CXSL2300410/1),即将开展用于治疗“原发性干燥综合征的成年患者”,以及“系统性红斑狼疮的成年患者”的临床研究。IBI355是信达生物针对自身免疫性疾病开发的一款CD40L靶向抗体药,具有提升疾病控制效果的潜力,旨在解决长期用药的毒性问题。
4.联邦三靶点激动剂获批降糖临床。联邦制药1类化药UBT251注射液获国家药监局临床试验默示许可,临床适应症为“2型糖尿病”。UBT251是一款长效GLP-1/GIP/GCG三靶点受体激动剂,预期临床每周皮下注射给药1次。在临床前研究中,UBT251已在多种动物模型中已显示出降低血糖和体重,改善肝脏脂肪变性和纤维化的潜力。
5.君实PD1单抗上半年销售4.47亿元。8月30日,君实生物发布2023H1业绩报告,上半年营收6.7亿元,同比下滑29.21%,净亏损9.97亿元,研发投入9.49亿元,同比下滑10.7%。营收的下滑主要是该公司与礼来、Coherus的合作协议相关的许可收入及特许权收入减少导致。2023年上半年,特瑞普利单抗收入约4.47亿元,同比增长约50%;新冠小分子口服药氢溴酸氘瑞米德韦片销售额为1.10亿元;阿达木单抗生物类似药收入6800万元。
国际药讯
1.罗氏PD-L1单抗皮下剂获批英国上市。罗氏PD-L1抗体Tecentriq(atezolizumab)皮下制剂获英国药品和医疗产品监管署(MHRA)批准上市,涵盖其静脉制剂在英国所获批的所有适应症(包括某些类型的肺癌、膀胱癌、乳腺癌和肝癌)。在Ib/Ⅲ期试验IMscin001中,与需要30-60分钟的静脉(IV)输注相比,只需7分钟的皮下注射Tecentriq在血液中的水平(药代动力学)显示出非劣效性。Tecentriq皮下制剂也正接受FDA和EMA的监管审查。
2.BMS心肌病新药长期疗效积极。百时美施贵宝心肌肌球蛋白别构抑制剂Camzyos(mavacamten)治疗症状性梗阻性肥厚型心肌病(oHCM)的两项Ⅲ期临床(VALOR-HCM和MAVA-LTE)长期随访结果积极。VALOR-HCM研究56周分析显示,Camzyos持续降低需要接受侵入性室间隔减容疗法(SRT)患者的比例,Camzyos组和安慰剂交叉组这一数值分别为8.9%vs19.2%。MAVA-LTE研究120周分析显示,患者LVOT(左心室流出道)阻塞、症状和NT-proBNP水平均持续改善,没有新的安全性信号。
3.VMAT2抑制剂亨廷顿病Ⅲ期临床成功。Neurocrine公司囊泡单胺转运体2(VMAT2)抑制剂Ingrezza(valbenazine)治疗亨廷顿病(HD)相关舞蹈病(chorea)的Ⅲ期临床KINECT-HD达到主要终点和次要终点。最新数据显示,最低剂量Ingrezza(40mg)治疗在第2周即起效,患者疾病评定量表(UHDRS)最大舞蹈症(TMC)评分较安慰剂显著降低(-4.6 vs. -1.4分;P<0.0001),疗效维持12周;该组达到CGI-C(临床总体变化印象)和PGI-C(患者总体印象变化)指标改善的患者比例也显著更高(CGI-C:42.9%vs13.2%;PGI-C:52.7%vs26.4%)。
4.MPS II酶替代疗法Ⅰ/Ⅱ期临床积极。Denali公司酶替代疗法DNL310治疗II型黏多糖贮积症(MPS II)的Ⅰ/Ⅱ期临床最新结果积极。数据显示,DNL310治疗显著降低患者神经元损伤标志物血清神经丝蛋白轻链(NfL)水平,两年降幅达64%;DNL310耐受性良好。详细数据将公布于SSIEM2023年会上。DNL310是一款由IDS蛋白与Denali的酶转运载体(ETV)结合的融合蛋白药物,已分别获得FDA和EMA授予的快速通道资格和优先药品资格。
5.诺和诺德超4.7亿欧元收购Embark Biotech。诺和诺德宣布将以高达4.56亿欧元款项收购Embark Biotech公司,并获得其先导代谢项目,用于肥胖和2型糖尿病的治疗。Embark Biotech是2017年从哥本哈根大学诺和诺德基础代谢研究中心(CBMR)所分拆出来的公司。这是诺和诺德本月的第二项并购交易。8月中旬,诺和诺德已以高达10.75亿美元的现金收购Inversago公司,获得该公司CB1反向激动剂INV-202,以及其他用于代谢和纤维化疾病的临床前项目资产。
6.诺华终止TGF β单抗所有临床开发。诺华致函XOMA Corporation公司,宣布停止TGF β单抗NIS793相关的开发活动,将停止其余TGFβ临床项目中招募患者,以及将在试验结束后收集所有数据。NIS793最初由XOMA开发,是一款靶向TGF-β的潜在FIC抗体,通过抑制TGF-β通路以发挥抗肿瘤作用。此前,诺华已开展多项NIS793的临床试验,适应症包括转移性胰腺导管腺癌、转移性结直肠癌、肺癌等。
医药热点
1.两院院士增选有效候选人名单公布。8月31日,中国科学院、中国工程院公布2023年院士增选有效候选人名单。此次中国科学院院士增选有效候选人为583人,其中生命科学和医学学部共109人;中国工程院2023年院士增选有效候选人655人,医药卫生学部有85人。根据院士增选指南名额分配细则,中科院生命科学和医学学部,与工程院的医药卫生学部最终增选院士共计不超过26名。根据统计,北京大学、复旦大学、上海交通大学排在有效增选候选人人数的前三,分别有14人、11人和9人。
2.传染病疫情风险评估管理办法出台。8月31日,国家疾控局印发《传染病疫情风险评估管理办法(试行)》指出,各级疾控主管部门应负责建立健全风险评估的工作制度和工作机制,负责风险评估工作的组织协调等。国家级和省级疾控主管部门应组建由预防医学、临床医学、基础医学等学科和专业方向的专家组成的风险评估专家组,对可能导致重大公卫风险的特定传染病疫情开展风险评估。
3.国家级尿控盆底疾病诊治中心分中心在重医附一院成立。近日,国家老年医学中心尿控盆底疾病诊治中心重医附一院分中心成立授牌仪式举行。国家级尿控盆底疾病诊治中心分中心正式在重医附一院成立,该中心的成立将促进医院在尿控盆底疾病诊治领域的发展,同时带动重庆及周边地区该亚专业水平的整体提高,让更多患者获益。
评审动态
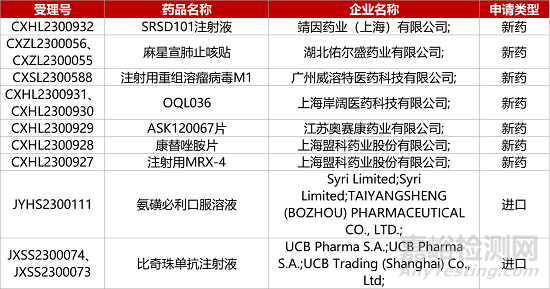
1. CDE新药受理情况(08月31日)
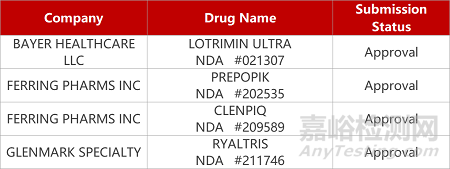
2. FDA新药获批情况(北美08月29日)