伴随着全球的新冠大流行,新冠疫苗备受关注。目前市面上的新冠疫苗有三个类型:传统灭活疫苗、腺病毒载体疫苗以及信使RNA (mRNA)疫苗。传统的灭活疫苗我们比较了解,它是将经过处理、没有传染性和致病性的病原体注入人体,让免疫系统认识这种病原体,从而达到预防的目的。腺病毒载体疫苗是用另外一种非复制型的病毒将想要免疫的病原体DNA注入人体。相较于这两种疫苗,mRNA疫苗更具设计与制造的简便性、固有的免疫原性、快速量产性等优势。
而且随着生物技术和分子医学的快速发展,mRNA引入人体作为疫苗或治疗剂能够产生几乎所有功能性蛋白,这代表着一个精准医学领域正在崛起,其在预防和治疗许多难治性疾病方面前景广阔。因此,小编今天和大家分享之前发表在Signal Transduction and Targeted Therapy杂志上(IF:18.817)的关于mRNA治疗的综述,为大家进一步介绍mRNA治疗的现状。
图1. 基于mRNA治疗的关键发现和进展
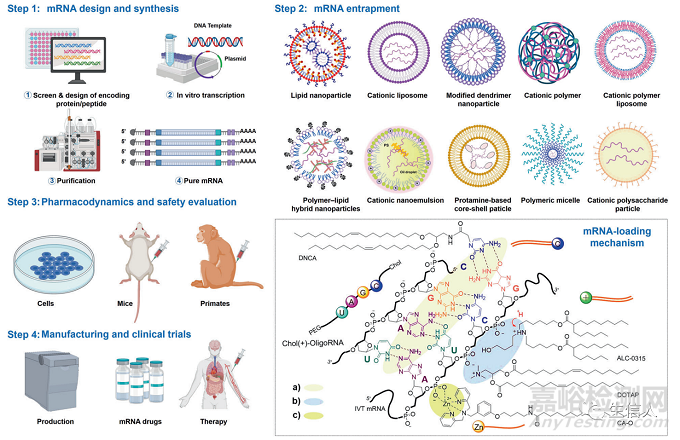
mRNA治疗的发展主要包括mRNA的设计、合成、包封、药效学、药代动力学、体内和体外安全性评价、生产和临床试验(图2,表1)。其中mRNA的设计和合成是关键步骤,想要获得高度生物活性RNA也通常依赖于可靠的设计。因此,在这一部分,作者重点关注并讨论了mRNA设计和制造。并从以下几点进行了介绍:
图2. mRNA药物生产流程
表1. mRNA药物制备中的关键质量控制
1、mRNA的结构成分
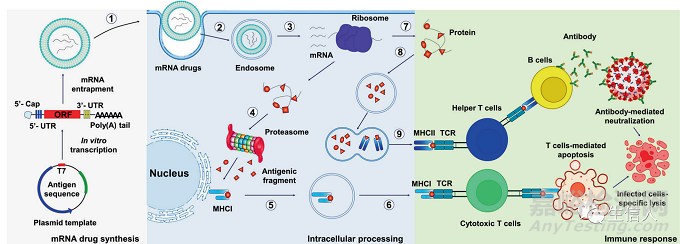
要了解mRNA治疗,首先要了解mRNA结构。mRNA是由转录过程产生的,真核生物中RNA聚合酶在体内将基因转化为初级mRNA转录本时合成前体mRNA,通过加工进一步成为成熟mRNA 。成熟mRNA包括编码区、非编码区(UTR)、poly(A)尾和5′帽结构,它们可以被核糖体识别并被tRNA携带产生蛋白质。
与DNA一样,mRNA中的遗传信息包含在核苷酸序列中,这些核苷酸排列成密码子,每个密码子由三个核糖核苷酸组成。因此,通过刺激真核细胞mRNA合成机制来完成体外RNA转录,能够确保mRNA在体内的表达(图3)。所以mRNA的优化对于成功的mRNA治疗至关重要。
图3. 体外转录(IVT) mRNA及翻译起始
2、mRNA翻译和衰变
真核mRNA翻译起始是一个精细调控的过程,涉及到组装一个多蛋白及RNA复合物,指导核糖体到起始密码子。而mRNA在核糖体中会被解码,产生特定的氨基酸链。研究发现翻译过程和mRNA衰变过程之间存在一种平衡(图4)。先前的研究表明,结构元件与mRNA的衰变密切相关,尤其是5 '帽和poly(A)尾。基于这些功能元件的重要性,有大量研究集聚焦于mRNA结构的优化,如开发一系列5 '帽类似物、改变poly(a)尾长度等。
图4. mRNA衰变的机制
3、mRNA设计
这一部对mRNA设计进行了介绍。首先介绍的是5 '帽。5 '帽位于mRNA的5 '端,甲基化程度不同(图5),许多mRNA结构优化策略致力于优化帽类似物。接着介绍的是poly(A)尾。Poly(A)尾通常由10-250个腺嘌呤核糖核苷酸组成。Poly(A)尾是mRNA的动态添加物,其的长度对mRNA翻译效果和蛋白表达起着至关重要的调控作用。
此外,作者也介绍了5′-UTRs和3′-UTRs。mRNA 3′和5′末端的UTRs不编码蛋白但在调控mRNA翻译和蛋白表达中起重要作用。UTRs参与mRNA的亚细胞定位,调节mRNA的翻译效率和稳定性。5′-UTRs和3′-UTRs共同调控蛋白质的表达水平,5′-UTRs主要参与启动翻译过程,而3′-UTRs主要影响mRNA的稳定性和半衰期。作者也对开放阅读框(ORF)进行了介绍,ORF的设计主要集中在密码子的优化和功能肽的引入以及复制过程。
图5. 商业化和常用的Cap
4、RNA化学式设计
这一部分作者主要介绍了两类RNA。首先是自扩增RNA (Self-amplifying RNA, saRNA):与传统mRNA相比,saRNA是另一种结构不同的mRNA分子。saRNA主要来源于甲病毒,通过替换病毒结构蛋白的基因序列编码来构建。因此,saRNA可以利用甲病毒的先天特性,以一种有效的方式产生大量感兴趣的蛋白质。
其次是环状RNA、非编码RNA和竞争性内源RNA:环状RNA (circRNAs)是单链、共价闭合的RNA分子,在从病毒到哺乳动物中普遍存在。CircRNAs可作为蛋白质诱饵、支架和招募者,通过充当转录调控因子、microRNA海绵和蛋白质模板发挥生物功能。环状RNA 独特的结构使其具有更大的稳定性、更长的半衰期和更大的RNase R抗性,这是线性mRNA缺乏和期望的。
5、mRNA的制造
针对mRNA的制造,作者主要对RNA的合成与优化进行了介绍。体外转录(IVT) mRNA是用线性化质粒DNA模板或PCR模板进行的,需要至少一个启动子和相应的mRNA构建序列。获得mRNA的过程需要加帽,通常采用两种方法:共转录加帽和转录后加帽。而IVT mRNA的Poly(A)尾通常编码在DNA模板中或通过酶促作用附着在IVT mRNA上。当poly(A)尾延伸编码在模板载体中时,会出现悬臂,这妨碍了IVT mRNA的翻译效果,需要通过IIS型限制性内切酶替换II型限制性内切酶来避免。
6、mRNA纯化
IVT mRNA合成后会与RNA聚合酶和DNA模板混合,因此纯化IVT mRNA是必要的,包括去除免疫刺激污染物,游离核糖核苷酸,短mRNA和DNA模板。一般情况下,会用DNA酶降解多余的DNA模板。商业纯化试剂盒则用于纯化和分离合成的mRNA,然后乙醇或异丙醇沉淀可以去除大部分污染物,以获得高纯度的mRNA,然后用高浓度的LiCl或醇基沉淀、色谱法,或从硅胶膜柱中洗脱,可以去除蛋白质、游离核苷酸及其他成分,但不能去除dsRNA杂质。为了去除转录反应液中的dsRNA污染物,一种新的纯化方法RNase III被提出,其能够显著降低mRNA的免疫原性。
综上所述,纯化mRNA的方法多种多样,纯度要求和尺度不同,应根据研究或应用的目的而定。显然,无论使用何种方法进行纯化,严格的mRNA质量控制是确保mRNA治疗最大效益的核心。
2、mRNA运载系统
mRNA的传递仍然是当前基于mRNA治疗的一个巨大挑战。因此在文章的第二大部分作者列出了多种mRNA运载系统,并从多个角度对运载系统进行了介绍。
1、mRNA运载体
文章首先就对运载mRNA的脂质纳米粒进行介绍(图6)。首先介绍的是阳离子固体脂质纳米粒,阳离子脂类广泛用于mRNA传递。接着作者又介绍了可电离脂质纳米颗粒,有研究已经将可电离的氨基脂质Dlin-MC3- DMA (MC3)用于临床治疗。接着介绍的是具有免疫刺激作用的脂质纳米颗粒,有研究开发了具有环状氨基头基团的脂质,可激活细胞内STING通路,会显著延长了生存期,增强了抗肿瘤疗效。
其次是,聚合物纳米颗粒:聚合化合物及其衍生物可以由天然或合成材料合成,具有多种可能的结构和特性。其中PEI是最有效的非病毒基因载体之一。此外还有,阳离子纳米乳剂:1990年,CNEs被提出作为一种潜在的核酸输送系统,已被证明可以有效地输送核酸用于各种疾病的治疗。其中在配方中加入阳离子脂质是通过静电作用进行核酸络合的必要条件,这对于提高核酸的稳定性和转染效率,防止核酸被核酸酶降解也是必不可少的。
最后是,其他mRNA传递系统:也有一些其他类型的载体被开发用于传递mRNA,其中包括精蛋白浓缩mRNA、外泌体、细胞外囊泡(ev)、介孔二氧化硅、CaP等。
图6. 运载mRNA的脂质纳米颗粒中带正电荷的脂质
2、影响mRNA运载的其他因素
接下来文章对影响mRNA运载系统的其他因素进行了介绍。其中包括:体外和体内mRNA传递的屏障,mRNA传递的屏障一直是该领域思考的重点,研究者通过增加细胞摄取,促进溶酶体逃逸,加速翻译来最大限度地提供mRNA。研究发现mRNA在纳米颗粒的帮助下进入细胞质涉及多个步骤:包括内吞作用、溶酶体逃逸和mRNA释放,其中细胞膜是细胞内运输的一个动态和强大的屏障。而纳米颗粒会通过多种机制与细胞膜相互作用。
此外,了解mRNA的细胞摄取机制是mRNA高效传递的前提。mRNA传递系统的佐剂活性:阳离子脂质体本身作为佐剂,其主要功能是保护抗原不被清除,并将抗原传递给专业的APCs。管理路径对传递效率的影响:给药途径在mRNA给药系统中起着至关重要的作用,因为一些特定的疾病需要特定的给药途径,尽管静脉给药可以满足大多数疾病的需要,但肺部疾病等则宜采用吸入或气管内给药。此外,不同给药载体在不同给药路径下的分布或表达也不同。
3、mRNA治疗的应用
基于mRNA的治疗有望成为多种难治性疾病的有力治疗手段,包括传染性疾病、代谢性遗传疾病、癌症、心脑血管疾病和其他疾病(图7,表2)。因此,在这一部分作者对mRNA治疗的应用进行了详细介绍。主要包括以下几种:
图7. 基于mRNA的治疗策略和潜在应用
表2. mRNA治疗学的发展现状
1、直接基于编码分子的mRNA疗法
以mRNA为基础的免疫治疗通过表达抗原然后启动免疫反应,被定义为一种间接治疗,其不以病毒或肿瘤细胞的mRNA编码治疗蛋白。而mRNA疗法通过传递基于mRNA的功能性蛋白直接治疗疾病则是一种直接策略,这些功能蛋白主要包括缺失或下调内源性蛋白、功能性外源蛋白或抗体,以及用于基因编辑工具的蛋白。
2、基于mRNA单克隆抗体及免疫疗法
以抗体为基础的药物在生物制药领域取得了快速的进展,但单克隆抗体的脆弱特性以及高昂的生产、储存、运输和分销成本限制了其在世界范围内的应用。核酸编码的单克隆抗体,特别是基于mRNA的单克隆抗体,则为提高抗体治疗效果带来了很大希望。
此外,作者回顾了基于mRNA的药物应用,重点是预防和治疗传染病和癌症的疫苗的临床试验(图8)。其中抗传染病的mRNA疫苗中最经典的例子是SARS-CoV-2 mRNA疫苗:2019年SARS-CoV-2出现,并在全球范围内引发大流行,首个COVID-19疫苗被FDA批准紧急使用授权(图9)。
除此,也包括流感病毒mRNA疫苗、HIV mRNA疫苗、呼吸道合胞体病毒(RSV)mRNA疫苗、单纯性疱疹病毒(HSV) mRNA疫苗、水痘带状疱疹病毒(VZV) mRNA疫苗、人巨细胞病毒(HCMV)mRNA疫苗、狂犬病毒mRNA疫苗、登革病毒mRNA疫苗。而癌症疫苗则包括;黑色素瘤疫苗、恶性胶质瘤疫苗、急性髓性白血病疫苗、肾细胞癌疫苗等。
图8. mRNA药物利用疾病特异性靶向抗原策略诱导免疫
图9. SARS-CoV-2 mRNA抗原免疫原性及疫苗设计
3、mRNA癌症疫苗的耐受性及安全性
研究发现新表位可以绕过具有高免疫原性的中心耐受性,因为它们从不出现在正常组织中,并在癌细胞中产生基因突变的积累。因此,新表位被用于克服癌症疫苗的中心耐受性和解决肿瘤异质性的问题。而且mRNA疫苗也具有足够的安全性,其不良事件一般为轻至中度,包括注射部位反应,如疼痛、肿胀、红斑和流感样疾病,如疲劳、肌痛、发热和寒战。
4、mRNA疫苗佐剂
佐剂对于基于mRNA的治疗至关重要,尤其是mRNA疫苗,它可以放大和直接免疫应答。FDA批准了几种用于人体的佐剂,包括铝盐、MF59、AS01、AS03、AS04等。
5、基于mRNA的蛋白质替代疗法
蛋白质替代处理在用有利蛋白替代缺失或缺陷蛋白方面有着广泛的应用。基于mRNA的治疗方法已成为蛋白质替代治疗的新支柱,在多个领域得到了广泛的探索,包括心脏病、肺部疾病、血液系统疾病、代谢性疾病、癌症、骨科疾病、神经源性疾病、肌肉萎缩等。
6、mRNA编码肽及蛋白质
mRNA编码的肽和蛋白的功能是选择靶向细胞治疗药物的关键因素,直接影响mRNA的治疗设计。对于需要翻译后修饰以组装成功能类型多肽的细胞,需要使用适当的蛋白质转化酶或内蛋白酶来精确传递。而蛋白质则需要分泌到细胞外才能发挥其功能。因此,mRNA需要被传递到具有自然分泌功能的细胞中,否则需要将相应信号肽mRNA序列插入到分泌蛋白的ORF附近。
7、基于mRNA的基因编辑疗法及CRISPR/Cas核酸酶系统
mRNA被广泛用于传递可编程核酸酶。mRNA具有瞬时表达、无突变风险的特点,是基因编辑治疗中极具吸引力的方法,目前,多个基于mRNA基因编辑的临床试验正在进行中。此外,人工核酸内切酶的发展带动了基于mRNA的基因编辑技术的高速发展。mRNA药物通过编码人工核酸内切酶,如ZFNs、TALENs和最近的CRISPR/Cas核酸酶系统,调节细胞基因组信息。
8、基于mRNA的治疗
在文章最后作者对基于mRNA的治疗进行了介绍,主要包括基于mRNA的T淋巴细胞治疗、基于mRNA的自体T细胞治疗、基于mRNA的CD4+ T细胞治疗、基于mRNA的干细胞治疗、基于mRNA的多能干细胞(iPS)治疗及基于mRNA药物的联合治疗。
小结
到这里这篇文章的主要内容就介绍完了,文章对基于mRNA的治疗工具进行了全面的介绍,从mRNA的结构、制造、传递到应用,全文参考文献近600篇,内容非常丰富。
目前mRNA治疗正在快速崛起,是一个非常有前景的研究领域,由于其在灵活性、成本和开发速度方面的优势,该技术为传染病和个性化药物提供了巨大的好处和潜力。当然,要充分发挥这项技术的潜力,仍然需要克服包括缺乏扩大mRNA过程的经验和知识及靶向递送技术等挑战。