您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-11-11 08:38
首次人体试验方案设计中很关键的一项课题就是起始剂量计算。起始剂量计算用的比较多的一个指南是FDA于2005年颁布的“Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers”,大致原理是采用动物NOAEL/NOEL折算成人体等效剂量(human equivalent dose, HED),可以基于体重(BW),也可以基于体表面积(BSA)进行换算。相对来讲,BSA的转换得到的HED更低,更为保守。比如小鼠、大鼠和犬,以BW换算比BSA分别要高12、6和2倍。那么寡核苷酸类药物应该以哪种路径计算呢?
FDA 2005年这个指南里面有几句相关描述:The toxicity in humans (for a particular class) is dependent on an exposure parameter that is highly correlated across species with dose on a mg/kg basis. For example, complement activation by systemically administered antisense oligonucleotides in humans is believed to be dependent upon Cmax (Geary et al. 1997). For some antisense drugs, the Cmax correlates across nonclinical species with mg/kg dose and in such instances mg/kg scaling would be justified.
CDE在《健康成年志愿者首次临床试验药物最大推荐起始剂量的估算指导原则》中有同样描述:药物在人体的毒性反应依赖于某暴露参数,而不同种属之间这一参数与mg/kg剂量密切相关。例如,人体反义寡核苷酸全身给药后所产生的补体激活依赖于Cmax。对于某些反义核酸类药物,各种动物种属之间Cmax与mg/kg剂量相关,在这种情况下按mg/kg换算是合理的。
这种毒性表现主要在食蟹猴中出现,且在含有硫代磷酸(PS)或其他类型骨架修饰的单链寡核苷酸中出现。已有很多文献证明PS修饰的寡核苷酸血液中的毒性确实与Cmax有很好的相关性,而不同种属间的血浆PK参数与体重相关性更好。那么问题来了,除了血液毒性呢?PS修饰的寡核苷酸出现的其它病理改变,不同种属间也与体重更相关吗?对于这种情况,有人建议,除非血液中的毒性是剂量限制性毒性,比如在药物低剂量就观察到明显的血液中毒性,且比其它病理学发现更为严重,否则对于PS修饰的寡核苷酸或者其他类型的寡核苷酸,还是建议基于BSA路径进行种属间剂量换算。不过,虽然这个思路理论上有些道理,即BW主导且更相关的毒性以BW计算,反之则以BSA计算,但很明显,不太具备可操作性。
其实除了一些生物药物外,大部分种类的药物均是通过BSA进行种属间换算。最早BSA的提出是在细胞毒类抗癌药物中出现的。毕竟基于BW推算会低估人体的敏感性。也有一种说法是BSA与代谢速率之间有很好的相关性。小动物如啮齿类对小分子抗癌药的代谢和清除较大动物更快,即能更快的祛毒。所以BSA更为合理。其实,BSA确实是目前大部分药物主流采用的种属间剂量换算方法,也是被FDA 2005年这个指南重点推荐的。
不过,寡核苷酸类药物还是有一些特殊性的。寡核苷酸类药物主要被核酸内切酶和外切酶代谢,由内体摄取、单核细胞吞噬等介导清除,这点与小分子细胞毒类药物有很大不同。所以,寡核苷酸类药物也不能完全照搬细胞毒类药物的计算方法,无差别按照BSA进行种属间换算。寡核苷酸类药物使用BSA计算的一个基本前提是,啮齿类动物毒性表现较大动物不敏感,获得的NOAEL或NOEL过高。这种情况,采用BW换算,人体风险会比较大,BSA方法更为保守,也就更保险。但是,还有些情况,寡核苷酸类药物在啮齿类种属中的毒性敏感程度与非啮齿类相当,甚至更敏感。也要强制使用BSA进行剂量换算吗?是否应该考虑使用最敏感种属的NOAEL,基于BW换算更合理。尤其是一些威胁生命的疾病如肿瘤,一味的坚持BSA的保守算法,可能会使很多患者暴露于无效剂量之下,将面临伦理问题。
这里就要回答一个底层问题,小分子细胞毒类药物采用BSA,是因为BSA与动物代谢速率之间相关性更好。那寡核苷酸类药物代谢特征与BW或BSA中的哪个更相关呢?寡核苷酸类药物具备独特的PK特征,如广泛的组织分布、相对长的组织半衰期、核酸酶代谢等。Yu及其团队2015年公布了一项研究结果,采用小鼠、食蟹猴单次或多次,经皮下或静脉给予9个ASO药物,考察了BW、BSA与暴露量AUC的相关性。结果发现,基于BW计算,食蟹猴的暴露量与剂量的比例,在人体的2倍以内,具体见下表。小鼠则比人体低5倍。故,基于食蟹猴的剂量进行人体HED计算,可以采用BW,按照1:1种属间换算。如果基于小鼠剂量换算,则需要一个5-11倍的缩放系数。无独有偶,Nanavati及其团队2021年发现了类似情况,GalNAc偶联的ASO由于肝脏摄取和分布,具备较高的血浆清除率,基于BW的1:1缩放进行非人灵长类和人体间剂量换算是可靠的。其实,前文所述的FDA 2005年指南中的表述也类似,某些ASO,各种动物种属之间Cmax与mg/kg剂量相关。

说来说去,寡核苷酸类药物究竟怎么计算首次临床起始剂量更合理呢?2024年,FDA也公布了一项研究和统计(Sydney Stern, 2024)。FDA统计了内部数据库中自2015年1月到2024年1月期间开展FIH试验的寡核苷酸药物相关资料,包括自1998年9月以来至2024年1月期间批准上市的RNA寡核苷酸药物。共计89个IND和16个获批上市的寡核苷酸药物纳入分析。89个IND中,33个皮下给药,24个静脉给药,22个鞘内给药,5个玻璃体给药,还有几个其它给药途径的。79个披露最敏感种属的IND产品中(含所有给药途径),60个是非人灵长类,13个是啮齿类,5个则啮齿类和非人灵长类均是,1个是仓鼠。49个经皮下或静脉给药的寡核苷酸药物中,33个最敏感种属是非人灵长类,12个是啮齿类,4个啮齿类和非人灵长类均是。
57个经皮下或静脉给药IND产品中,17个是采用动物数据,基于BSA转换获得人体HED,再结合安全因子10,获得MRSD。10个产品是采用BW进行的转换。剩余30个则未明确起始剂量是基于BW还是BSA进行的缩放。另外,GalNAc偶联的寡核苷酸几乎全是经皮下注射给药,其中9款基于BSA,8款基于BW进行的种属间缩放,算是旗鼓相当。这里说明下,局部给药的寡核苷酸不在讨论之列,比如鞘内给药的,按照最敏感种属的脑脊液体积进行折算即可,本文主要讨论系统给药途径。
16款FDA批准上市的寡核苷酸类药物中,2款基于BSA换算,4款基于BW换算,2款鞘内给药的基于脑脊液体积,其余的未在提交给FDA的资料中明确。
89个IND中,80个在临床方案中披露了NOAEL,估计有些肿瘤适应症未披露。选择最敏感种属的NOAEL(大部分来自非人灵长类),经BSA或BW折算人体等效剂量,作为依据之一。另外,75%的寡核苷酸类药物同时会在早期临床进行target engagement或药效学测试,以辅助进行剂量选择。FDA披露了此次数据统计和研究的示意图,如下图所示。

FDA这篇研究最后的结论我就不翻译了,分享如下:
(1) generally, two species, including NHPs, for scaling may be useful to predict parameters for oligonucleotides expected to have systemic concentrations;
(2) while no consensus was reached in our analysis, literature indicates BSA-based scaling may provide a conservative estimate in predicting human pharmacokinetic parameters; however, BW-based approaches are often utilized and more research is warranted to determine the optimal method;
(3) design and validate a pharmacodynamic assay early in development to guide dose and dosing interval selection and proof of target engagement;
(4) where possible, leverage available information from other oligonucleotide therapeutics in the same chemical class.
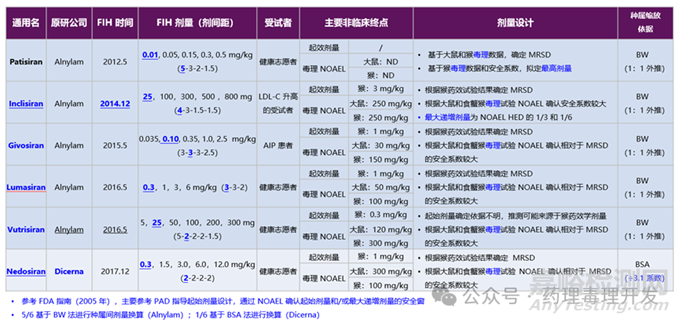
鼎泰集团的研究团队前期对已上市的6款siRNA产品做过系统的总结和梳理,笔者经得鼎泰集团朋友的允许,借花献佛,公开如下,在此表示感谢。6款已上市siRNA产品名称、爬坡剂量、主要非临床终点、临床剂量设计思路等如下表所示。5款Alnylam的siRNA药物均是基于BW外推,1款Dicema公司的产品基于BSA外推,大部分产品是采用猴药效试验结果进行的人体外推。药理学终点如药理学活性剂量(PAD)也就派上了用场。另外,FDA也指出同类产品的其他寡核苷酸药物数据也可以参考。比如Arrowhead同平台的三款siRNA产品ARO-ANGPTL3、ARO-HBV、ARO-AAT的首次临床起始剂量均为35mg/人。
最后
不难看出,目前对于寡核苷酸类药物首次临床起始剂量计算的规则,尚无统一标准。从药代动力学角度,无论2005年FDA指南还是公开文献,似乎BW与药代参数相关性更好,尤其是来自非人灵长类的数据。从2024年FDA披露的统计数据,89个IND中,以最敏感种属NOAEL,经BSA和安全因子折算,占比偏多一些。其实可以反算下,非临床最敏感动物NOAEL经BW换算,加上10倍安全因子,得到的MRSD大都远高于实际的起始剂量,更接近最高剂量,除非调整安全因子。不过,NOAEL并不是唯一计算依据,FDA 2005年指南也给出了PAD路径,大部分已上市siRNA是经猴PAD剂量,基于BW换算,得到的可靠人体起始剂量。最后,其它同类型或同平台寡核苷酸药物已有数据也可以作为起始剂量设计的依据之一。

来源:药理毒理开发


