2023年10月9日,专注于提供心衰治疗解决方案的医疗技术公司Endotronix, Inc. 宣布,其多中心研究 PROACTIVE-HF 2已获得 FDA 的器械临床实验豁免(IDE)批准。该研究将评估公司用于肺动脉(PA)压力引导治疗的 Cordella 传感器。
这项前瞻性、双臂试验旨在将产品应用扩大到纽约心脏协会(NYHA) II 级心力衰竭患者,并通过临床医生指导的患者自我管理策略,支持高效且可扩展的远程患者管理。
田纳西州Vanderbilt大学医学中心心力衰竭专家兼PROACTIVE-HF 2临床试验全球首席研究员 Lynne W. Stevenson 博士表示,在过去 15 年里,支持对 NYHA III 级心力衰竭患者进行 PA 压力引导治疗的证据得到了一致验证。然而,关于 NYHA II 级患者的治疗益处以及如何最好地扩展有效的远程心力衰竭管理的问题仍然存在。
PROACTIVE-HF 2 的随机组将是第一项将 PA 压力引导治疗与远程医疗对照组进行比较的研究。单臂队列评估参与患者的力量以及随后对治疗效果的影响。这些研究可以帮助更好地了解肺动脉高压随时间变化对右心室功能的影响,并为如何通过患者参与来扩展这一重要治疗提供指导。
▲图片源自公司官网(下同)
PROACTIVE-HF 2 前瞻性、开放标签随机对照临床试验将在美国和欧洲招募多达 1500 名患者。双组研究设计于周末在 HFSA 上公布,预计将于今年晚些时候招募第一位患者。随机组将评估使用 Cordella 对有充血风险的 NYHA II 级患者进行 PA 压力引导治疗的安全性和有效性。在这两个队列中,患者和临床医生都可以访问每日趋势远程医疗数据(即血压、心率和体重),治疗队列也可以访问每日 PA 压力数据。
该研究将使用首次 HF 事件或死亡率来评估安全性和有效性,持续时间长达 24 个月。这项单组研究将使用 12 个月的安全性终点以及心力衰竭住院或死亡的发生率,来评估临床医生指导的患者在家自我管理对有不良结局风险的 NYHA III 级心力衰竭患者的影响。
此外,Endotronix 公司在 HFSA 会议上展示了其初始关键 PROACTIVE-HF 试验的 12 个月子研究数据,表明 NYHA III 级心力衰竭患者 12 个月时心力衰竭住院率较低为 0.34。
Endotronix 首席执行官兼联合创始人 Harry Rowland 表示,公司正在利用早期 PROACTIVE-HF 数据为 Cordella 建立令人信服的临床证据基础。研发团队正努力在今年年底前提交 PMA,并期待在 2024 年分享完整研究队列的结果。公司对 Cordella 为患者和临床医生带来的改善心力衰竭治疗的益处仍然充满信心,并有望在 2024 年中期上市。
关于 Cordella 平台
Cordella平台能够为患有慢性心力衰竭的患者提供全面的、可报销的健康管理,包括基于云计算的疾病管理数据系统和基于植入式无线肺动脉传感器的门诊血液动力学管理系统,该系统用于早期监测心力衰竭。
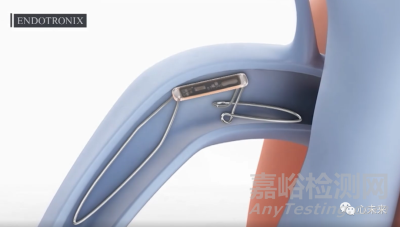
Cordella主要由Cordella传感器和体外管理平台组成。其中Cordella传感器是一个大小与回形针相当的小型传感器,通过其专有的输送系统注入到肺动脉。该装置就可以检测到肺动脉压力值的上升,这是肺部积液和充血性心衰即将发作的早期预警,甚至比出现呼吸急促或体重增加症状还要早。肺动脉压力信息被记录下来,从患者家中无线传输到云端,这样医生就可以通过云端实时查看数据,并主动调整治疗方案,使患者心衰病情得到控制,从而延长患者生命以及改善生活质量。
关于 Endotronix
Endotronix成立于2007年,由机械工程师和心胸外科医生联合创立。公司提供数字医疗技术解决方案,将基于云技术的病人管理系统与可植入肺动脉传感器相结合,以用于改善门诊血液动力学管理现状。