今日头条
维眸中美双报JAK1调节剂获FDA批准II期临床。维眸生物小分子JAK1免疫调节剂VVN461获FDA临床许可,拟开展Ⅱ期临床评估用于治疗白内障术后炎症的安全性与有效性。VVN461能够高活性抑制多个炎症细胞因子(cytokine)通路,从而减轻和缓解眼部的炎症反应。今年2月,该产品获国家药监局临床试验默示许可,拟用于治疗非感染性眼前节葡萄膜炎患者。
国内药讯
1.信达/葆元ROS1/NTRK抑制剂报产。信达生物和葆元医药联合开发的新一代ROS1/NTRK抑制剂泰莱替尼(他雷替尼,DS-6051)的上市申请获CDE受理,用于治疗既往接受过ROS1-TKI治疗的ROS1融合阳性非小细胞肺癌(NSCLC)患者。在II期TRUST-II研究中,DS-6051在初治患者中经确认的客观缓解率(cORR)达到92%;在既往接受过1种ROS1-TKI抑制剂治疗的患者中,cORR为57%。此外,泰莱替尼的总体耐受性良好。
2.宜联B7-H3靶向ADC获食管癌孤儿药资格。宜联生物靶向B7-H3的创新抗体偶联药物(ADC)YL201获FDA授予孤儿药资格,用于治疗食管癌。该产品采用宜联自主创新的TMALIN®技术平台,结合肿瘤微环境和传统溶酶体胞外胞内双重裂解机制,已在临床前研究中显示出可有效抑制多种肿瘤生长,且具有良好的耐受性。目前,宜联生物正在中美开展YL201用于多瘤种剂量扩展研究。
3.益普生IBAT抑制剂拟纳入优先审评。益普生回肠胆汁酸转运蛋白(IBAT)抑制剂odevixibat胶囊因“符合儿童生理特征的儿童用药品新品种、剂型和规格”被CDE拟纳入优先审评,拟用于治疗6个月或以上患者的进行性家族性肝内胆汁淤积症(PFIC)。Odevixibat可阻断肠胆汁酸经过肠肝循环回流入肝,从而减轻肝脏内及循环内的胆汁酸浓度。该产品已获FDA批准用于治疗3月龄及以上的PFIC患者,以及Alagille综合征(ALGS)。
4.可瑞生物TCR-T国内获批实体瘤临床。可瑞生物首个免疫细胞治疗产品“CRTE7A2-01 TCR-T细胞注射液”获国家药监局批准开展Ⅰ期临床,拟评估用于治疗HPV16阳性HLA-A*02:01阳性晚期实体肿瘤(宫颈癌、头颈部肿瘤、肛门癌和其他肿瘤类型)的安全性、耐受性和初步疗效。该产品可通过靶向抑制HPV16 E7突变的表达,阻止细胞最终向恶性方向转化,具有良好的抗肿瘤活性。目前,该新药正在美国开展Ⅰ期临床,预计明年11月完成试验。
5.百济神州13.3亿美元购进CDK2抑制剂。百济神州与Ensem Therapeutics就后者口服细胞周期蛋白依赖性激酶2(CDK2)抑制剂达成合作许可协议,百济神州获得该新药全球独家许可权利。Ensem的CDK2抑制剂与百济神州自主研发、已处于临床Ⅰ期的CDK4抑制剂形成补充,有望为乳腺癌患者提供治疗选择。根据协议,Ensem将获得一笔首付款,研发、注册和商业化里程碑潜在付款,交易总金额可能高达13.3亿美元。
6.先声引进康乃德生物IL-4Rα单抗。先声药业与香港康乃德生物就后者临床期IL-4Rα单抗Rademikibart签订合作许可协议,获得Rademikibart在大中华地区开发、生产和商业化独家权利。Rademikibart能与IL-4Rα中一个独特的区域结合,阻止受体与其他受体亚基相互作用,从而治疗特应性皮炎(AD),哮喘等Th2介导的疾病。根据协议,康乃德将获得1.5亿人民币预付款,高达8.75亿人民币的开发和商业里程碑潜在付款,以及产品的销售分成。
国际药讯
1.强生CD38单抗骨髓瘤Ⅲ期试验积极。强生与Genmab公司开发的CD38抗体皮下注射制剂Darzalex Faspro(daratumumab)联合标准疗法一线治疗新确诊多发性骨髓瘤的Ⅲ期PERSEUS临床积极结果公布于ASH2023年会上。47.5个月随访数据显示,daratumumab联合治疗较标准治疗使疾病进展风险降低58%(p<0.0001);两组的48个月无进展生存率分别为84.3%和67.7%;安全性特征与既往研究一致。
2.BET抑制剂骨髓纤维化III期研究成功。MorphoSys公司潜在“first-in-class ”BET抑制剂pelabresib联合芦可替尼一线治疗骨髓纤维化患者的III期MANIFEST-2研究达到主要终点和关键次要终点。与芦可替尼单药组相比,pelabresib联合治疗第24周时脾脏体积较基线减少35%或以上(SVR35)的患者比例更高(66%vs35%,p<0.001);患者的总症状评分(TSS)降低值更大(-15.99vs-14.05分,p=0.0545)。药物的安全性与既往研究一致。
3.赛诺菲CD40L抗体启动MS的Ⅲ期临床。赛诺菲CD40L抗体Frexalimab在Clinicaltrials.gov网站上注册两项Ⅲ期临床,拟评估Frexalimab(AR441344)用于治疗成人非复发性继发性多发性硬化(MS)、以及复发型MS患者中的有效性和安全性。Frexalimab可阻断适应性(T细胞和B细胞)和先天性(巨噬细胞和树突状细胞)免疫细胞激活和功能所必需的共刺激CD40/CD40L细胞通路,而不会耗尽淋巴细胞。该产品目前为赛诺菲自免领域的核心管线之一。
4.自体BCMA CAR-T将进入Ⅲ期临床。Selecta公司与Cartesian公司宣布合并为一家上市公司,由Selecta公司的Carsten Brunn博士领导,专注于自身免疫性疾病领域开发RNA细胞疗法。公司合并后将重点推进Cartesian的首发管线mRNA工程化自体BCMA CAR-T疗法Descartes-08开展Ⅲ期临床,用于治疗全身性重症肌无力(gMG)。在Ⅰb/Ⅱa期临床中,Descartes-08在给药约三个月后,患者重症肌无力综合(MGC)量表平均改善超过50%。
5.Quotient初创公司获5000万美元融资。Quotient Therapeutics宣布获得Flagship Pioneering投资的5000万美元资金,以进一步推进其体细胞基因组(Somatic Genomics)技术平台,开发旨在治愈、预防或逆转疾病的潜在“first-in-class”药物,应用于自身免疫性疾病、癌症、心脏代谢疾病、传染病、神经系统疾病和罕见病领域。该平台由Flagship科学家与Wellcome Sanger研究所和得克萨斯大学西南医学中心的顶尖遗传学家合作创建。
6.默沙东收购神经退行性疾病制药商。默沙东宣布以6.1亿美元收购Caraway公司,并获得该公司神经退行性疾病和罕见病产品管线。Caraway是一家处于临床前阶段的生物制药公司,专注于开发治疗神经退行性疾病和罕见病的创新疗法。该公司主要通过调节溶酶体功能来激活细胞再循环过程,从而清除有毒物质和有缺陷的细胞成分。
医药热点
1.2023年两院院士增选结果公布。11月22日,中国科学院网站和中国工程院网站分别发布了《关于公布2023年中国科学院院士增选当选院士名单的公告》和《关于公布中国工程院2023年院士增选当选院士名单的公告》。2023年中国科学院选举产生了59名中国科学院院士,其中,生命科学和医学学部11人(平均年龄54.8岁),包括被誉为无创DNA产前检测的奠基人卢煜明,著名心血管病学专家王建安,以及今年全职归国,出任深圳医学科学院创始院长的结构生物学家颜宁(45岁)。颜宁也是今年两院新增院士中最年轻的一位。中国工程院2023年院士增选共选举产生74位中国工程院院士,其中,医药卫生学部11人(平均年龄58.6岁)。
2.深圳医学科学院揭牌成立。11月21日,由颜宁担任创始院长的深圳医学科学院正式揭牌成立。深圳医学科学院(SMART)是一家集医学综合研究、人才培养和成果转化于一体的高级学术机构。该院将通过构建科技、人才、教育“三位一体”的创新高地,坚持需求和问题导向,鼓励源头创新,聚焦前沿与应用,探索全新科研机制,汇聚全球高水平科学家,搭建国际一流医学研究平台。
3.2022年四川省新增97家互联网医院。近日,四川省卫健委公布2022年四川省卫生健康事业发展统计公报,截至2022年末,全省医疗卫生机构总数为74041个。其中:医院2465个,基层医疗卫生机构70671个,专业公共卫生机构686个。2022年底全省已审批设置262家互联网医院,比上一年增加97家;当年在线提供健康咨询、在线复诊和电子处方等服务1400余万人次,比前一年增加100余万人次。2022年全省医院次均门诊费用309.86元,同比上涨1.67%。
评审动态
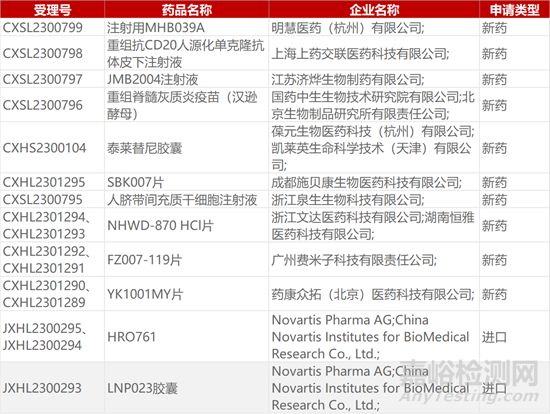
1. CDE新药受理情况(11月22日)
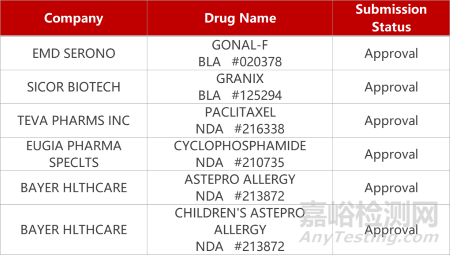
2. FDA新药获批情况(北美11月21日)