您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-26 09:28
摘要
目的:进一步提高化学创新药沟通交流质量和效率,加大创新药研发支持力度,强化对申请人的技术指导和服务。方法:结合创新药不同注册申请阶段药学相关技术指南和审评实际,就相关沟通交流中药学部分存在的问题提出建议。结果与结论:针对化学创新药不同注册申请阶段沟通交流中的常见问题提出解决路径及关注要点,希望能为药品注册申请人提供借鉴,同时提升沟通的质量和效率,更好地服务于药品创新与发展。
【关键词】化学药品;创新药;沟通交流;审评
沟通交流是在药物研发与注册申请技术审评过程中,申请人与药审中心审评团队就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流,是申请人与审评团队信息互通的重要桥梁,也是促进药物创新的重要措施之一。
1、国内沟通交流背景
早在2008年,国内就建立了沟通交流制度[1-2]。自2015年审评审批制度改革以来,国家药品监督管理局药品审评中心(以下简称药审中心)已构建了多渠道、多层次的沟通交流机制,以鼓励创新药的研发和申报。2021年,国务院办公厅发布的《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发[2021]16号)指出,优化沟通交流方式和渠道,增加创新药品医疗器械会议沟通频次,强化对申请人的技术指导和服务。为适应行业发展需要,2023年10月药审中心又召开了改进沟通交流服务企业座谈会,提出要进一步优化工作程序,细化沟通交流资料要求,指导申请人与审评团队进行更加高效的沟通。同时,药审中心围绕沟通交流已开展了多次行业培训。申请人应充分发挥主体责任,依法依规、规范严谨地开展沟通交流。
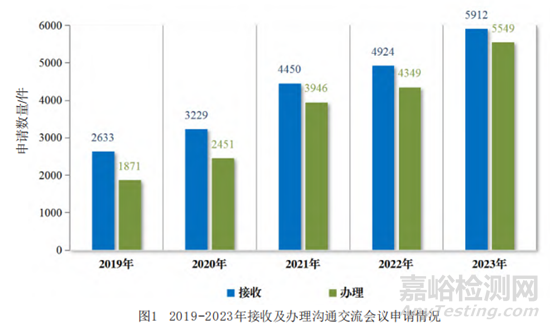
2023年度药品审评报告[3]显示,近5年沟通交流接收及办理数量均呈逐年上升趋势(见图1)。按办理量统计,2023年药审中心办理沟通交流会议申请5549件,在药物研发关键阶段的Ⅱ类会议占比最高,为54.69%,其中新药临床试验申请前(PreIND)申请、新药上市许可申请前(Pre-NDA)申请占比分别为23.33%、9.66%[3]。
2、沟通交流
2.1 新药临床前沟通交流
《药物研发与技术审评沟通交流管理办法》第七条规定,首次新药临床试验申请前,申请人原则上应当向药审中心提出沟通交流会议申请,并在确保受试者安全的基础上,确定临床试验申请资料的完整性、实施临床试验的可行性。
《新药Ⅰ期临床试验申请技术指南》指出,在Ⅰ期临床试验申请时,药学审评通常重点关注与安全性相关的问题,例如杂质、稳定性、无菌制剂生产条件和除菌/灭菌方法,以及临床前动物安全性评价试验与后续人体临床试验所用样品的质量可比性等。对于部分风险情形相对较高的品种,如合成多肽、高分子聚合物、多糖、小分子核酸、生物来源提取物、PEG化小分子等结构或制备工艺相对复杂、采用创新技术的品种,以及其他涉及复杂情况的品种(如药械组合、特殊治疗机理等),提出新药临床前沟通交流是有必要的。
该阶段,由于尚处于早期研发阶段,申请人提供的资料较为有限,提出的问题多比较模糊,如现有研究是否满足新药临床申报要求等。建议申请人就想了解的关键问题具体提出,并尽量提供相对充分的研究数据以支持审评人员提供合理化建议。
2.1.1 起始物料和中间体
该阶段申请人一般可无需参照ICH Q11及其问答(Q&A)要求选择起始物料。但用于制备临床试验样品的原料药的起始原料的杂质水平不可高于毒理批次原料药采用的起始原料支持的杂质水平。还应关注起始原料与原料药制备工艺可能引入的毒性溶剂、试剂等的残留,并按照相关技术要求对临床样品进行控制。对于一些复杂原料药(如小核酸、多肽、多糖等)使用的起始物料,鉴于原料药合成工艺过程控制的复杂性,一般需要有更严格的控制,以保证原料药符合既定质量要求。考虑新药研发的一般规律,现阶段可暂不对起始物料和中间体进行完整规范的质量研究,但应提供基本的研究验证资料,以保证数据的可靠性。
2.1.2 处方工艺及样品试制
建议申报Ⅰ期临床试验时(特别是涉及复杂原料药和制剂、复杂给药途径、药械组合产品时)在拟定的临床样品制备地点至少完成1批样品的制备,并且提供相关的试制信息、检验报告。如果拟定的临床样品制备地点与申报Ⅰ期临床试验注册批次样品制备地点不同,注意对生产地址、设备、批量等可能影响产品质量桥接的风险进行评估。目前部分申请人对复杂制剂提交的产品开发和工艺信息极为有限,建议对复杂制剂重要的生产步骤、设备和工艺参数等进行较为详细的描述,以便于后续累积数据,为后期可能的桥接提供支持。对于无菌制剂,应对无菌生产条件和除菌/灭菌方法等进行较为详细的描述,并且提供无菌保障措施。
某固体口服制剂毒理批样品原料药为二盐酸盐,临床批样品原料药为游离碱,不同的原料药形式可能导致理化性质和体内行为的差异,一般需进行体内PK桥接研究以确保临床试验的安全性。某吸入溶液剂,为了制备成溶液剂提高主药溶解度,制剂药液的pH值设计较低,并且药液溶剂用量较大。应关注pH较低时可能会引发呛咳的风险,单次剂量药液体积过大,会引发受试者顺应性和安全性风险。
2.1.3 质量标准和分析方法
参照《新药Ⅰ期临床试验申请技术指南》相关要求研究并制定临床试验样品质量标准。注意提供关键项目(如有关物质、残留溶剂、金属催化剂残留、致突变杂质、溶出度/释放度、含量等)的具体分析方法,以及必要的方法学验证信息(至少包括专属性、灵敏度等)。提供关键研究批次[包括用于安全性研究、稳定性研究、临床研究(如已制备)等批次]的检验报告,关注质量桥接时潜在的安全性风险。现阶段质量控制的重点是与安全性相关的研究和控制,对于关键理化特性、关键质量属性等项目应注意数据的积累。
某口服固体制剂原料药难溶,临床批样品原料药粒度经研磨后,较毒理批未研磨的原料药样品粒度明显降低,可能导致临床试验样品体内暴露量增加,进而导致潜在的安全性风险,需进一步评估,应关注毒理批样品与临床样品原料药粒度分布、给药形式等的可桥接性。
2.1.4 杂质研究
现阶段一般来说杂质研究信息有限,应至少确认杂质分析方法的专属性和检出能力。如涉及分析方法变更(如采用不同方法测定毒理批和临床批),需提供桥接研究资料。临床研究样品中的杂质水平不得超出动物安全性试验研究数据所支持的相应的杂质水平。对于致突变杂质,应参照ICHM7对药品(包含起始物料制备)中的相关工艺杂质(例如起始物料、中间体、副产物)、降解产物和有毒有害试剂等的潜在致突变性进行初步分析和研究。建议参照ICH M7采用(Q)SAR方法对结构已知的全部杂质进行预测和筛查。对于ICH M7中1类、2类杂质,应结合临床试验方案控制其不超过特定的可接受限度或者TTC值。临床试验样品中的致突变杂质水平需符合要求,保证临床试验阶段受试者的安全。提供潜在致突变杂质研究分析信息、检测结果或者相关的控制策略。同时,提供致突变杂质检测的分析方法以及必要的方法学验证资料,方法学验证需关注专属性和灵敏度。
对于预期生存期较短的复发难治的晚期癌症患者,现阶段技术评价中主要关注原料药加杂质的整体有效性和安全性,评价的基本技术要求是临床试验起始剂量下的杂质摄入水平具有安全性支持依据。若剂量爬坡试验中杂质摄入水平明显高于安全性支持水平,申请人应在人体试验剂量爬坡中控制用药剂量下的杂质总量,原则上不超过动物毒性试验可支持的杂质水平,若超过时应结合早期临床和/或非临床安全性数据进行风险评估。对于晚期癌症适应证,可参照ICH S9执行,但当治疗人群转变为更长生存期的不同人群时,应参考ICH M7来进行杂质控制。
2.1.5 稳定性
参照《新药Ⅰ期临床试验申请技术指南》相关要求开展药品稳定性试验并提供相关研究资料。对于临床试验中需要进行配伍使用(例如注射剂)或者有特殊使用要求的制剂,一般应提供相关配伍稳定性试验或者使用中稳定性试验的初步研究结果,关注配伍过程中新产生杂质的安全性以及注射剂不溶性微粒、溶液澄清度等情况,关注使用中产品光照、氧化等条件下可能产生的新降解杂质。
稳定性研究时应关注考察项目的全面性。如部分申请人未对晶型、手性杂质、水分等开展稳定性研究,未关注有关物质增加和含量下降显示的物料不平衡问题,长期稳定性新增超过界定限的杂质未提供充分的安全性依据,特殊制剂未能结合产品特点考察特殊的关键质量属性,如脂质体的zeta电位、pH值、微观形态和结构、粒径等。
2.1.6 辅料和包材
Ⅰ期临床试验申请时,对于国内外制剂中尚未使用过的全新辅料,以及新材料、新结构、新用途的包材,需按照相关要求进行关联申报或将辅料、包材的研究资料随制剂一并提交。申请人可首选登记状态为A的辅料和包材,如选择登记状态为I的辅料和包材至少应提供在国内外上市或在研制剂中已有使用的依据,并提供辅料用量的安全性依据,如使用生物来源辅料,应提供潜在外源因子风险控制和病毒去除和/或灭活的研究及验证资料。对于拟用于儿童适应证的药品,应对辅料种类和用量在适龄人群的安全性进行评估。
2.2 关键临床试验前沟通交流
申请人是创新药研发和注册申报的责任主体,应伴随临床试验的开展,结合药物自身特点和前期临床试验研究阶段积累的认知和生产经验,尽早针对临床试验通知书中药学相关遗留问题,并对照《创新药(化学药)Ⅲ期临床试验药学研究信息指南》等技术要求完善相关研究。对于工艺复杂和质控难度大的原料药(例如多肽、小分子核酸、聚合物产品、含多个手性中心、含发酵工艺或者天然来源等药物)、复杂制剂(例如微球/微乳/脂质体、胶束、透皮制剂、吸入制剂、混悬型注射剂等)以及复杂药械组合产品等,建议申请人在关键临床试验前就药学研究中的关键技术问题与审评团队进行充分讨论。对于拟采用药品加快上市注册程序(如附条件批准程序等)的创新药,关键临床试验前(如Ⅱ期临床试验前)的沟通交流也可按如上要求开展,药学研究计划应与临床试验研究计划相统一。此类药品申报上市需符合上市申请技术要求,不因加快程序而降低药学研究的技术要求。
2.2.1 起始原料的选择
申请人应参照ICH Q11及其问答(Q&A)合理选择起始原料,与审评团队讨论起始原料选择的合理性,提供起始原料选择的相关支持性研究资料。同一起始原料有多个生产商的,需结合生产商采用的制备工艺制定相应的质控要求,应关注不同生产商的起始原料对原料药关键质量属性的影响。对于发酵、提取等来源的起始物料,申请人需参照ICHQ11指导原则评估起始原料选择的合理性,必要时应前延工艺路线,一般应将发酵、提取步骤纳入药品生产质量管理规范管理。对于结构相对简单(如氨基酸)或具有较长生产历史、已在多种原料药的生产工艺中使用、质量属性已认知充分的发酵制备物料(如6-APA、7-ACA),在保证质量控制满足要求的前提下,可以参照ICH Q11要求作为起始原料[4]。需注意起始原料的选择应与料药杂质谱的研究与控制相关联,以减少起始原料质量对原料药的影响。
该阶段,申请人应考虑起始原料选择不合理对后续注册进程的影响。提供起始原料选择的依据时,应综合考虑ICH Q11及其问答(Q&A)各项要求,结合起始原料的合成工艺及后续杂质清除转化研究,提供充分的杂质研究数据和起始原料的质量控制信息,注意杂质研究应有“连贯性”,并且应与分析方法相关联,分析方法应对杂质有足够的分离检出能力。
2.2.2 处方及工艺
该阶段是原料药合成工艺、制剂处方工艺等的基本确定阶段。一般建议关键临床试验前应尽早确定处方工艺、生产场地、生产批量等。对于复杂制剂、皮肤外用制剂等,建议关键临床试验样品的产地、处方工艺及生产批量等与申请上市许可保持一致。对于吸入制剂、药械组合产品,申请上市许可时宜采用与关键临床试验相同的给药装置。用于关键临床试验样品的处方工艺等如发生变更,需参照《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》等相关要求开展药学变更研究,充分评估处方工艺变更对制剂质量、安全性和可衔接性的影响,必要时考虑开展体内桥接研究。
2.2.3 质量研究与控制
鼓励参照ICH Q6A拟定原料药和制剂的质量标准,用于生产注射剂等的原料药还应关注微生物限度、细菌内毒素。关注临床试验期间质量标准的变化情况(包括项目、方法和限度),注意Ⅲ期临床试验与Ⅰ/Ⅱ期临床试验质量标准的衔接,质量标准如发生变更,应参照临床试验期间药学变更指南开展变更研究。关键临床试验期间需继续积累研究数据,完善质量标准。建议申请人根据研究需要控制原料药的粒度和粒度分布,采用可靠的检查方法测定临床试验样品原料药的粒度和粒度分布,关注粒度差异对体外溶出和体内PK的影响,开展溶出方法区分力研究,累积关键临床批等粒度数据(包括D10、D50、D90)。建议参照ICH Q3D制定制剂中元素杂质评估与控制研究计划。对于吸入、口服、黏膜、皮肤和鼻腔给药的水溶液非无菌制剂,一般应参照相关技术要求对洋葱伯克霍尔德菌群进行研究,制定相应的控制策略[5]。
申请人应根据药物pH-溶解度曲线以及制剂质量控制的需要,持续完善溶出度或释放度方法研究,对溶出度或释放度研究进行汇总和评估,提供方法选择的合理性依据,制定溶出度或释放度方法区分力研究方案。制剂辅料种类、用量或生产工艺等发生重大变更的,需重新评估确认溶出度或释放度方法的可行性。
致突变杂质可参照ICH M7开展研究,亚硝胺类杂质(NDSRI)需参照亚硝胺杂质相关技术要求[6-9]进行风险评估和必要的研究,制定合理的控制策略。
2.2.4 晶型的控制
如需特殊操作以保持晶型批间一致性,应关注相应的过程控制措施及必要的中间产品控制。关注制剂生产及储存过程中晶型稳定性研究,关注晶型检测方法的专属性和灵敏度,必要时将晶型订入质量标准。需注意原料药盐型变化对晶型的可能影响,应加强盐型的筛选研究。
该阶段,应注意晶型/盐型研究的充分性,提供晶型转化、盐型筛选的充分数据,尽量避免在关键临床期后再次变更晶型/盐型或者部分转晶的情形,一般不建议采用混晶。
2.3 新药上市申请前沟通交流
新药上市申请前沟通交流是药品上市许可申请前的重要沟通交流会议,是后续新药申请顺利审评的重要保障。申请人应充分利用前期沟通交流会议解决临床试验期间药学相关问题,并伴随临床试验的进展,不断累积对产品关键质量属性的认知和生产经验,结合临床试验进程制定合理的药学研究计划。该阶段为药品整个临床开发期间的末尾阶段,应符合药品安全性、有效性和质量可控性的基本原则,关注各阶段样品质量桥接。应完整参照相关技术要求,解决前期遗留的各类药学问题以确保满足上市要求,该阶段仍然存在一些问题,如杂质谱研究不充分,未能结合合成工艺和过程控制及降解路径研究完整全面地论述杂质谱。对原料药及原料药杂质结构中含仲胺的,应参考国际药品监管机构(包括WHO等)发布的亚硝胺杂质相关技术要求,对相关亚硝胺杂质进行风险评估,在风险评估和确认的基础上,需要时及时与药理毒理审评团队沟通确定合理的可接受限度,结合NDSRI风险评估结果以及多批次样品检测数据(包括稳定性)制定NDSRI合理的控制策略。另外,需注意应严格按照前期沟通交流意见开展相关研究,以免影响注册进程。
3、结语
申请人作为药物研发和注册的责任主体,应结合相关技术要求,对拟沟通交流问题进行梳理,提交用于交流的真实、完整的支持性资料,并梳理相应阶段重点关注的内容,尽量明确待沟通的具体问题,并且不回避研发中存在的问题,以保证注册进程有序进行。
参考文献
[1] 李培. 国内药品注册沟通交流制度介绍与思考[J]. 中国药事,2021,35(12):1340-1346.
[2] 国家食品药品监督管理局药品审评中心加强对外沟通交流 促进审评公开透明[J]. 中国药事,2009,23(3):257.
[3] 国家药品监督管理局药品审评中心. 2023年年度药品审评报告[EB/OL]. [2024-08-01]. https://www.cde.org.cn/main/news/viewInfoCommon/9506710a7471174ab169e98b0bbb9e23.
[4] 赵一飞,官梦歆,王亚敏. 化学创新药审评中基于ICHQ11的考虑[J]. 中国新药杂志,2023,32(7):666-669.
[5] USP NF. General Chapters<60> Microbiological Examinationof Nonsterile Products-Tests for Burkholderia CepaciaComplex[S]. 2022.
[6] European Medicines Agency. Nitrosamines EMEA-HA5(3)-1490-Assessment Report,EMA/369136/2020[S].2020.
[7] European Medicines Agency. Questions and Answers forMarketing Authorization Holders/Applicants on the CHMPOpinion for the Article 5(3) of Regulation (EC) No 726/2004Referral on Nitrosamine Impurities in Human MedicinalProducts, EMA/409815/2020 Rev.12 [S]. 2022.
[8] US Food and Drug Administration. Guidance for Industry:Control of Nitrosamine Impurities in Human Drugs[S].2021.
[9] 国家药品监督管理局. 化学药物中亚硝胺类杂质研究技术指导原则(试行)[S]. 2020.

来源:中国药事


