您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-15 14:14
根据《医疗器械分类目录》,中医脉诊设备的管理分类为Ⅱ类,管理代号为20中医器械-01中医诊断设备-01脉诊设备,指通常由主机、加压装置和压力传感器组成。经压力传感器通过皮表对桡动脉及周边组织的腕部寸、关、尺部位以无创的方式,在施加外力的条件下进行脉图采集的设备。本文同样适用于中医临床采集、存储脉象数据,计算脉象参数信息的设备。
一、中医脉诊设备产品的结构组成和工作原理
1、结构组成
中医脉诊设备通常包含压力传感器、加压装置、数据采集部件。不同类型的脉诊产品可能包含:电脑主机、软件、显示设备,以及其他为实现中医脉象数据采集、存储、计算功能而配合使用的模块或部件。产品典型结构示意图见图1。
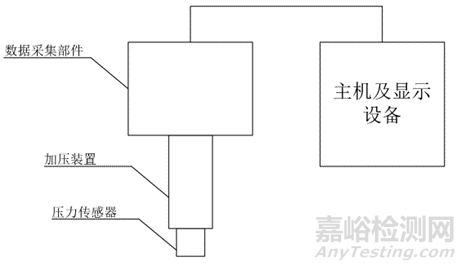
图1 脉诊仪产品典型结构示意图
2、工作原理
中医脉诊设备通过加压装置将压力传感器压至腕部桡动脉寸、关、尺部位,并施加不同的压力,通过数据采集部件及其他配合使用的模块实现对中医脉象数据的采集、存储、计算等功能。
按照操作方式分为自动加压和手动加压,手动加压为操作者采用手动的方式操作加压装置,实现申报产品施加在桡动脉采集位置的压力变化。自动加压为申报产品可以通过电子装置实现施加在桡动脉采集位置的压力变化。
根据加压装置的工作原理,自动加压一般分为气动加压和电机加压两种方式。气动加压装置通过可调节内部压力的气囊与传感器连接,通过改变气囊内压强来推动压力传感器,实现不同压力下采集脉图数据。电机加压装置通过电机推动压力传感器实现不同压力下采集脉图数据。
产品工作原理见图2。
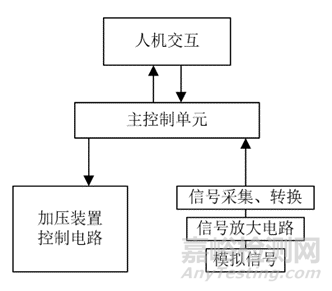
图2 产品的工作原理图
二、中医脉诊设备产品性能研究实验要求
1、生物相容性研究
依据GB /T 16886.1标准要求开展生物学评价。按照患者直接接触具体部件进行相应的评价。设备一般与人体皮肤接触的部件有传感器、加压装置、辅助采集模块。例如,传感器与腕部皮肤短期接触,按照GB /T 16886.1标准的要求,生物相容性评价至少应考虑以下方面的要求:细胞毒性、致敏、刺激或皮内反应。对不同接触类型的部件应分别进行评价。豁免进行试验的项目宜明确理由。
2、软件研究
产品结构组成中若包含作为医疗器械组成部分的软件,应参照《医疗器械软件注册审查指导原则(2022年修订版)》的要求开展研究,内容包括基本信息、实现过程、核心功能、结论等内容,详尽程度取决于软件安全性级别(严重、中等、轻微)。其中,基本信息包括软件标识、安全性级别、结构功能、物理拓扑、运行环境、注册历史,实现过程包括开发概况、风险管理、需求规范、生存周期、验证与确认、可追溯性分析、缺陷管理、更新历史,明确核心功能、核心算法、预期用途的对应关系。软件功能的验证与确认至少应体现适用范围中宣称的测量功能,且应当与其它申报资料保持一致。
产品若具备电子数据交换、远程控制或用户访问功能的独立软件和含有软件组件的产品,应当参照《医疗器械网络安全注册审查指导原则(2022年修订版)》开展研究,基本信息包括软件信息、数据架构、网络安全能力、网络安全补丁、安全软件,实现过程包括风险管理、需求规范、验证与确认、可追溯性分析、更新维护计划,漏洞评估明确已知漏洞相关信息。应开展自研软件网络安全研究。
3、清洁消毒研究
开发人应开展清洁消毒研究。申报产品在使用前应对与患者接触部件进行清洁消毒处理。应当明确推荐的清洗和消毒工艺(方法和参数)、工艺的确定依据并开展验证。
4、稳定性研究
使用期限一般主要取决于使用过程中部件、元器件的损耗、老化等,开发人应按照声称的使用期限对设备进行老化/疲劳试验,也可对影响设备使用期限的关键部件进行老化/疲劳试验,例如设备中不可更换(或更换成本高)的部件。研究应能证明上述部件按照所声称的使用期限,经过老化/疲劳试验后,产品性能和安全仍符合预期的要求。使用期限也可基于已有数据进行合理的推断、分析、计算得出。可参考《有源医疗器械使用期限技术审查指导原则》的要求。
开发人对包装和产品进行模拟试验,模拟在贮存和运输过程中,遇到极端情况时,例如环境(温湿度、气压等)变化、跌落、振动、加速度等,产品不会发生性能、功能改变,包装系统具有保护产品的能力。经过模拟试验后,观察包装外观是否有不可接受的异常现象,对产品进行性能测试,证明运输和环境测试后产品能够保持其完整性和功能性。环境试验可参考GB/T 14710的要求。
5、其他研究
除根据申报产品适用范围和技术特征提供非临床研究综述外,还应针对中医脉诊设备产品的具体特点,开展产品准确性的研究,如:数据采集准确性研究、参数计算准确性研究。
注明所有参数对应的定义信息,如h1定义为脉图最高点距离时间轴的长度。
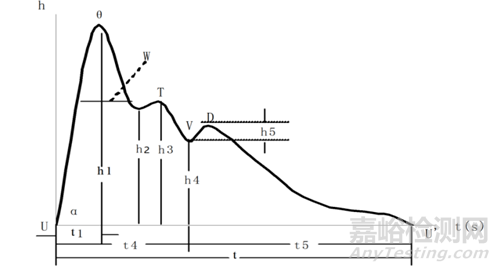
图3 脉图参数示意图
三、中医脉诊设备产品的主要风险
主要的风险包括生物学危害、环境危害、与使用有关的危害、软件危害、功能失效及老化有关的危害等,应按照GB/T 42062《医疗器械风险管理对医疗器械的应用》的要求对每种可能涉及的危害识别评估,为降低风险所执行风险控制,剩余风险的可接受性评定,产品受益相比综合评价。

来源:嘉峪检测网


