您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2025-01-06 08:07
一、原理
多重免疫组化(mIHC)是一种先进的技术,它允许在单个组织切片上同时检测多个靶标。这项技术主要利用了酪胺信号放大技术(Tyramide signal amplification, TSA)。简单来说,TSA技术是一类利用辣根过氧化酶(HRP)对靶蛋白或核酸进行高密度原位标记的酶学检测方法。
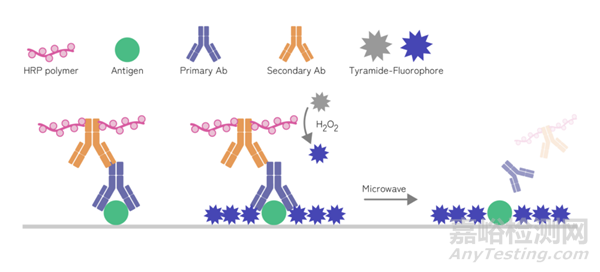
TSA荧光染料是由酪胺分子(tyramine,T)和荧光染料偶联而成。在过氧化氢(H2O2)环境中,非活性的酪胺分子(T)被二抗偶联的HRP催化激活发生大量的酶促反应,成为具有短暂活性的中间态分子(T*)并形成共价键结合位点,与邻近蛋白(包括靶抗原蛋白、一抗、二抗及HRP)的富电子区域(如色氨酸、组氨酸和酪氨酸残基)发生共价偶联而沉积。
偶联在酪胺分子上的荧光染料从而也在共价偶联蛋白周围大量沉积,使信号被有效放大。因为抗原—酪胺蛋白间的共价键键能的稳定性远高于抗原—抗体间的非共价键结合力,随后通过微波修复洗掉结合在抗原上的一抗—HRP二抗—TSA染料复合物,只保留与抗原偶联的TSA荧光染料信号。之后换不同靶蛋白抗体、换不同激发波长和发射波长的TSA染料进行第二轮孵育,周而复始,通过多轮复染即可实现组织的原位多靶点染色(最多可八标九色)。
二、HE染色评估组织质量
对所有样本进行HE染色,评估取材、组织脱水、包埋、切片等步骤是否合格。
三、免疫组化测试一抗
先用阳性组织石蜡切片确定一抗有效浓度(设置低,中,高3个浓度梯度),根据染色情况进一步调整。
四、TSA染料单标测试确定一抗浓度和染料搭配
1)组织自发荧光(Autofluorescence, AF)的检测:在进行免疫荧光染色之前,需要评估样本的自发荧光。自发荧光是样本在没有染色的情况下,由于组织内固有的荧光物质在特定波长照射下发出的光。使用光谱成像系统记录组织自发荧光的光谱特性,以便在后续实验中避免自发荧光与目标信号的重叠。即在为靶蛋白选择荧光染料时,应选择那些激发波长与组织自发荧光波长不同的染料,以减少自发荧光对实验结果的干扰。
2)使用TSA技术对单个靶标蛋白进行染色。在多重免疫荧光成像(如使用多光谱成像系统)中,记录每个靶标的荧光信号的曝光强度。根据记录的曝光强度和荧光信号,评估染色结果是否满足以下标准,①特异性:荧光信号应仅在目标蛋白处出现,阴性对照区域不应有非特异性信号。②曝光时间:良好的信号曝光时间应控制在50-200毫秒,以保证信号的清晰度和对比度。③曝光时间均衡:不同荧光通道的曝光时间应尽量均衡,相差不超过10倍,以保证图像的一致性。④同一激发通道的靶标:如果多个靶标使用相同的激发波长,它们的曝光时间应相近,以确保信号的可比性。
3)TSA单标染色使用的一抗稀释度需要根据IHC染色验证的DAB显色时间确定:如DAB显色时间为20-30sec,则将IHC验证好的一抗稀释度进一步稀释2倍;如DAB显色时间为40sec-1min,则将一抗稀释度进一步稀释1倍。
五、实验流程
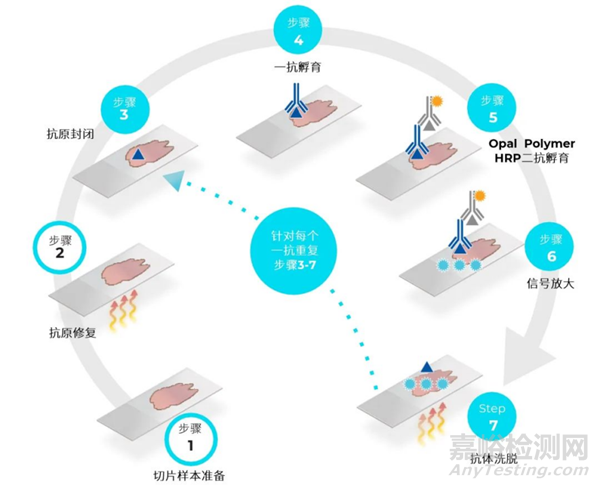
需要在前3个阶段均取得满意的结果之后,才可以进行多重荧光免疫组化染色。正式实验以前,选择1-2个小样本进行小量mIHC预实验,明确靶蛋白的染色顺序,确定好后开展正式实验,注意不要随意更改TSA染料单标染色已经验证好的实验条件:如一抗稀释度和孵育条件、抗原修复液类型和修复条件、二抗试剂种类和孵育条件。
1、切片、烤片及烘片
1)切片:使用粘附载玻片,肠癌组织切片厚度为5μm。若是组织芯片,需准备与组织芯片组织类型相对应的常规组织切片进行预实验条件摸索。
2)烤片:切片后立刻烤片,先60℃烤6-8小时,再40℃过夜保存,避免光照。切片后一个月内使用。这一步能避免组织在处理过程中脱落。
3)实验前烘片:实验前,将石蜡切片60℃烘片1小时。提高组织与载玻片的粘附力,防止在染色过程中脱落。
2. 脱蜡水合
1) 二甲苯脱蜡:新鲜二甲苯浸片10min,重复3次;或浸片30min,重复2次。去除切片中的石蜡,因为石蜡会阻碍抗体与抗原结合。
2)梯度乙醇浸片:100% 5min,重复2次;95% 5min;90% 5min;80% 5min。(3)灭菌水洗片1min,重复3次。这有助于温和地将组织从有机溶剂中过渡到水环境中,避免细胞和组织结构受损。
3. 后固定
10%中性福尔马林浸片10min,灭菌水洗片1min,重复3次。固定组织样本,保持细胞和组织结构的完整性,避免在处理过程中发生变性或破坏。
4. 封闭内源性过氧化氢酶(可选用)
1)新鲜配制 3%H2O2:20ml H2O2 (30%)+180ml milipore H2O。
2) 3%H2O2浸片15 min。
3) 水洗,3次,每次1min。
封闭组织中的内源性过氧化氢酶,防止它们在显色反应中产生背景染色,提高特异性。
5. 微波修复抗原
1)抗原修复液放入修复杯后置于微波炉内高火5min,至煮沸。
2)将脱蜡水合后的玻片置于预煮沸的抗原修复液中,保证片子全部浸没于抗原修复液。
3)低火维持15min(注意补液,防止蒸发过度导致干片)。
4) 取出放入冰水水浴中冷却至室温。
开放蛋白质的抗原表位,使抗体更容易与目标抗原结合,提高染色效果。
6. 封闭
1) 去除玻片上残存洗液。
2)用组化笔圈出玻片上的样本区域,滴加封闭液,覆盖样本区域。
3) 室温保湿振荡10min。
避免抗体在非目标区域非特异性结合,从而减少背景染色。
7.一抗孵育
1) 去除玻片上的封闭液。
2)用移液器滴加稀释的一抗溶液,浸没样本区域。
3)室温或37℃保湿振荡孵育1-2h(需针对不同抗体做优化调整)。
4)用1×TBST buffer浸洗玻片3min,重复3次。
8. 二抗孵育
1)去除玻片上残存的洗液。
2)直接滴加HRP标记的二抗工作液,浸没样本区域。
3) 室温保湿孵育10min。
4)用1×TBST buffer 浸洗玻片 3min,重复3次。
9.荧光染色放大信号
1) 去除玻片上残存的洗液。
2)滴加1×TSA 染料工作液100μL(用信号放大反应液按1:100稀释),浸没样本区域。信号放大,提高荧光信号的强度,使目标蛋白更易于检测。
3)室温保湿振荡孵育10min。
4) 1×TBST buffer 室温浸洗玻片3min,重复3次。
5) 微波修复洗脱,室温自然冷却至室温。
6) 灭菌水洗片1次,1×TBST buffer洗2min。
10.本轮染色结束,追加后续染色,重复第6步到第9步。
11.封片
1) 去除玻片上残存洗液,滴加DAPI工作液,室温保湿孵育10min。DAPI染色核酸,通常用于标记细胞核,提供细胞定位的参照。
2) 1×TBST buffer 浸洗玻片,室温3min,重复3次。
3)用灭菌水洗片。
4) 待玻片微干,用移液器在玻片上滴加抗淬灭封片剂,浸没样本区域。
5)加盖玻片,指甲油封片。
12.阅片
对染色后的组织切片用激光共聚焦荧光显微镜或多光谱组织成像系统观察和成像,并进行结果判读。
六、多重免疫组化结果解读
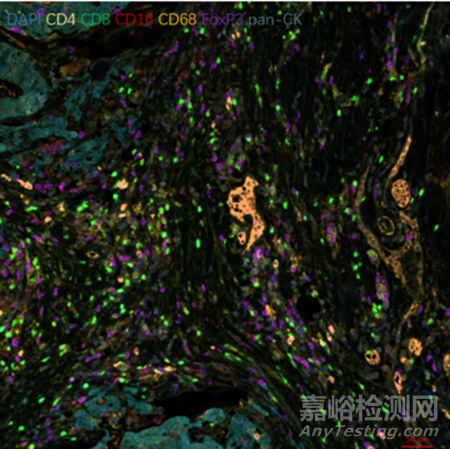
上图是笔者自己做的多重免疫组化的原图,下面就对上图进行解析,
在图像中可以看到以下几种标记:
DAPI:这种染料用来标记细胞核,发出蓝色荧光。在图中,所有细胞的核都被DAPI染成了蓝色,作为细胞定位的基础。
CD4:这是一种标记特定辅助T细胞的抗体,常用于识别免疫系统中的特定活跃细胞。在图中,CD4+细胞发出黄色荧光。
CD8:标记细胞毒性T细胞的抗体,这种细胞在免疫反应中具有杀伤功能。在图中,CD8+细胞发出绿色荧光。
CD16:这是标记自然杀伤细胞(NK细胞)的抗体之一。在图中,CD16+细胞可能发出红色荧光。
CD68:标记巨噬细胞的抗体,巨噬细胞是吞噬和清除外来微生物和死亡细胞的免疫细胞。CD68+细胞在图中发出橙色荧光。
FoxP3:这是一种标记调节性T细胞(Treg)的抗体,这些细胞有助于免疫系统保持自我容忍和防止自身免疫疾病。FoxP3+细胞在图中发出紫色荧光。
pan-CK(泛细胞角蛋白):标记上皮细胞的抗体,通常用于识别癌症中的上皮细胞。在图中,这些细胞可能呈现出蓝色或其他颜色。

来源:实验老司机


