您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-07-26 10:17
一次性使用手术衣为《医疗器械分类目录》中分类编码为14-13-05按第Ⅱ类医疗器械管理的一次性使用手术衣产品。
一、一次性使用手术衣的工作原理和结构组成
1.工作原理
产品通常采用具有特定阻隔性能的无纺布或薄膜复合材料制成,以缝制或热合等加工工艺制成,防止传染因子的传播,起到阻隔防护作用。
2.结构组成
一次性使用手术衣由具有一定防护特性的无纺布或覆膜复合材料制成,由前身、后身、袖子、系带等组成。手术衣的前胸和袖部至少应有关键区域(如图1所示),图1中A代表关键区域,B代表非关键区域。
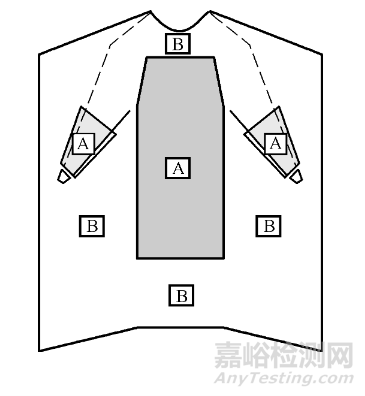
图1 手术衣关键区域和非关键区域图示
二、一次性使用手术衣的主要风险
一次性使用手术衣的主要风险见表
表 产品主要危险
|
危险 |
可预见的事件序列 |
危险情况 |
伤害 |
|
生物学危险 |
产品的材料选择未经生物学评价或使用生物不相容的材料 |
生物不相容的材料与使用者接触 |
引起使用者接触部位的过敏或皮肤刺激 |
|
产品没有灭菌或灭菌没有达到标准;使用超过灭菌有效期的产品;产品包装破损,产品被污染 |
灭菌失效、产品污染,使用者接触到有菌产品 |
引起交叉感染 |
|
|
产品二次使用 |
使用有菌或被污染的产品 |
引起交叉感染 |
|
|
信息 危险
|
包装标签信息不完整 |
外部标记不全面、标记不正确或不能够清楚易认 |
错误使用
|
|
说明书信息不完整,如未提示一次性使用、灭菌有效期;缺少详细的使用方法、必要的警告说明;未明确产品运输储存所需环境;未标示使用后的处理方法(如一次性使用产品用后按医疗废物处理);产品等级标示不清(如适用) |
产品不能正确使用、储存及处理 |
错误使用;储存或处理不当;产品无法正确辨别
|
三、一次性使用手术衣性能研究实验要求
1.原材料控制
应明确原材料质量控制指标及要求。
对于首次用于医疗器械方面的新材料,应开展该材料适合用于符合预期用途的相关研究。
2.产品性能研究
应明确产品化学、物理性能指标确定的依据,所采用的标准或方法、采用的原因及理论基础。
3.生物学特性研究
最终产品中预期与患者或使用者直接或间接接触的部分,均需要进行生物学评价。
依据GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》对相关用途、使用部位及接触时间的具体要求,结合申报产品的实际情况,确定生物学风险评定终点。可根据GB/T 16886《医疗器械生物学评价》系列标准进行相关评价。
若开展申报产品与市售产品的等同性比较的方式进行生物相容性评价,应按照《关于印发医疗器械生物学评价和审查指南的通知》要求进行评价,证明申报产品与已上市产品具有等同性
4.灭菌工艺研究
开发人应明确其灭菌工艺(方法和参数)和无菌保证水平(SAL),SAL应达到1×10-6,并开展灭菌确认。
如灭菌使用的方法容易出现残留,应当开展研究明确残留物信息及采取的处理方法。
5.稳定性研究
5.1货架有效期
应开展货架有效期研究,证明在货架有效期内,产品可保持性能功能满足使用要求。
产品有效期验证可采用加速稳定性试验或实时稳定性试验,开发人需在试验方案中设定检验项目、检验方法及判定标准。
5.2包装研究
产品包装主要对产品起到防护和无菌屏障的作用。产品包装验证可依据有关国内、国际标准进行(如GB/T 19633.1等),开展产品的包装验证。包装材料的选择应至少考虑以下因素:包装材料的物理化学性能;包装材料与产品的适应性;包装材料与成型和密封过程的适应性;包装材料与灭菌过程的适应性;包装材料所能提供的物理、化学和微生物屏障保护;包装材料与贮存运输过程的适合性。
6.其他
该产品已列入《免于临床评价医疗器械目录》(以下简称《目录》),对于符合《目录》中分类编码为14-13-05的,开发人需将申报产品相关信息与《目录》所述内容进行对比,和申报产品与已获准境内注册的《目录》中医疗器械的对比,具体的要求可参照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》。

来源:嘉峪检测网


