您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-08-02 09:17
引言:3D打印医疗器械由于其外形设计的不确定性,针对每个设计进行完整的台架试验是不现实的,也缺乏合理性,因而建立一种替代验证方法是当前和未来的需要。器审中心于2020年发布的《定制式个性化骨植入物等效性模型注册技术审查指导原则》(微信公众号内回复 等效模型 即可获得)给出了等效性模型的定义,并对等效模型建立的要求和方法进行了深入阐述。本文将结合等效性模型在生物医用3D打印骨科植入物中的应用来进一步说明等效模型的构建要求及方法,以供参考。
第一部分:背景信息
生物医用材料又称为“生物材料”,是诊断、治疗、修复或替换人体组织或器官,或增进其功能的一类高技术新材料。3D打印技术又称为“快速成型技术”或“增材制造技术”,是20世纪80年代后期发展起来的新型制造技术,主要是以数字模型文件为基础,根据零件或物体的三维模型数据,通过成型设备以材料累加的方式制成实物模型的技术,在高精度、个性化制造及复杂形状构建等方面具有独特优势。3D打印作为一种新型制造方式,极大拓宽了生物医用材料的应用范围,更好满足公众用械需求。
第二部分:等效性模型构建基本要求
等效性模型是为评价生物医用3D打印医疗器械临床预期使用性能而构建,与临床预期使用情况的几何结构、形貌、材料属性、固定方式、力学环境和生物整合机理等相等效的数值和物理模型。等效性模型需具有替代同等体内生理条件下物理模型的合理性,可用于评价生物医用3D打印医疗器械的安全性和有效性。等效性模型的构建需以临床实际需求为基础,针对不同手术部位和不同临床使用预期,设置功能评价目标和性能参数。等效性模型构建过程中对相关要素的简化需不影响对生物医用3D打印医疗器械临床使用安全性和有效性的评价。
第三部分:等效性模型构建方法
等效性模型的构建可采用物理试验、数值模拟分析、大数据分析、临床使用数据等,等效性模型构建的方法需规范,满足可重复性要求。为明确等效性模型的一致性和合理性,试验和数值模拟分析方法需结合使用,通过相关结果的对比验证构建方法的合理性。
以生物医用3D打印骨科植入物等效性模型构建为例,需从结构尺寸、材料属性、固定方式和力学环境等方面实现与植入物临床应用的等效,包括:1.几何结构特征、尺寸满足临床使用要求;2.材料属性赋值需包括模量、各向异性、梯度变化等;3.固定方式包括固定位置、方式需符合临床使用情形;4.力学环境包括所设定的力学、运动学加载条件需符合临床使用情形。
(一)几何模型的构建
几何模型是等效性模型的基础,几何模型的构建需包含植入物、固定系统及产生影响的全部组织结构和力学环境等要素。构建的几何模型尽可能的完整、准确、有代表性,与临床应用条件相一致,以保证构建模型的等效性。
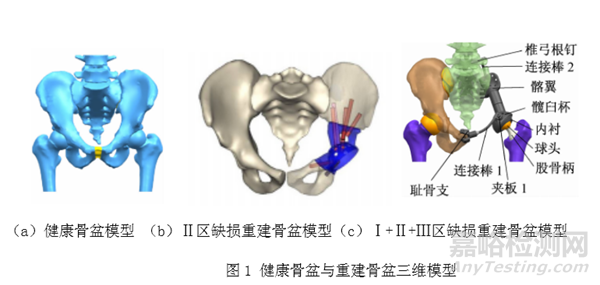
例如生物医用3D打印骨盆假体等效性模型需包含3D打印骨盆假体与人体天然骨盆,使两者形成完整的骨盆重建结构。人体天然骨盆数据通常来源于患者的CT扫描数据。构建骨盆假体等效性模型时需考虑骨盆的完整程度,是否包含股骨近端,如针对大段Ⅱ区骨盆修复的个性化植入物构建等效模型时,需考虑在等效模型中加入股骨与人工髋关节的重建模型。对于同时切除骨盆Ⅰ区、Ⅱ区 、Ⅲ区的情形,其重建骨盆假体除骨盆假体部分,人工髋关节假体部分以外,为提高假体固定稳定性,并且优化重建骨盆的力线传导方式,还可设计椎弓根钉棒系统,通过连接人工髂翼假体与腰椎和骶锥,来辅助固定髂翼假体[1]。图1给出了健康骨盆模型(图1a)、Ⅱ区缺损重建骨盆模型(图1b)、Ⅰ区、Ⅱ区 、Ⅲ区缺损重建骨盆模型(图1c)[1,2]。同时,需考虑骨盆中如骶髂关节、耻骨联合关节以及主要肌肉韧带等软组织的建立,以保证真实骨盆的力学传递特点。
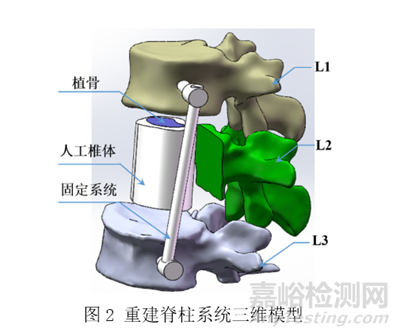
再如生物医用3D打印人工椎体等效性模型需包含3D打印人工椎体及其固定系统、与人工椎体相接触的上下相邻宿主椎段、与固定系统绑定的椎段和与该系统发生关联的肌肉或韧带组织。如对于将L2节段前柱切除的脊柱肿瘤患者,使用3D打印人工椎体进行重建,采用侧方固定方式,使用2根螺钉将L1与L3节段相连,重建脊柱系统三维模型如图2所示[3]。
针对数值模型构建中常面临的几何特征简化,非功能设计的结构小特征可以考虑简化,如便于加工的小倒圆或小倒边特征;与功能评价不相关的模型细节可以考虑简化,如一些情况下的螺钉螺纹。针对数值模型和物理模型构建中面临的组件简化,在不影响骨植入物功能评价的前提下可以考虑简化模型,降低等效性模型的复杂性。如骨植入物具有多孔结构,对于多孔结构的孔径梯度变化或随机排布的情况,在构建植入物等效性模型时不宜对其结构简化处理;对于多孔结构在植入物占比非常小,仅在植入物表面,如骨整合界面的多孔结构设计,不影响植入物整体的力学性能,在构建植入物等效性模型时可考虑简化为实体。
(二)网格划分
生物医用3D打印骨科植入物等效性模型网格划分需确定网格划分的方法、单元尺寸及分布变化、单元类型、网格数量,并根据实际模型的特征进行合理划分。有限元网格模型可优先考虑具有高计算精度的六面体网格,其次考虑四面体网格。对于形状不规则、变形和应力分布复杂以及计算精度要求高的区域考虑选用高阶单元。针对存在局部网格细化的情况,需指出其具体位置和局部网格尺寸。建议对关注区域的网格进行细化,同时确保单元尺寸平缓过渡,避免因相邻单元的质量和刚度差异造成错误的应力集中。一般重要评估区域的细小特征、孔结构、接触面等应对网格尺寸做细化处理。对模型网格划分的合理性进行网格质量评估,满足敏感性要求,差异阈值一般定为5%以内。
(三)等效性模型材料及其属性
等效性模型的材料属性是评价骨植入物功能的重要基础,人体骨骼各部位因受力环境和功能的不同,材料力学性能差异性较大,材料属性赋值的合理性是影响等效性模型准确性的关键因素。数值模型赋值时,骨结构模型划分为皮质骨和松质骨,可分别对其赋予均一的材料属性[3],或根据CT图像中灰度值与材料弹性模量的数学关系对材料属性赋值[4,5]。在Mimics软件中,按经验公式(1)由CT值计算骨骼物质密度ρ,再按经验公式(2)由密度计算弹性模量E。

式中,H.U为亨氏单位,为CT图像中的灰度值;ρ为骨骼密度;E为弹性模量。
表1列举了骨盆等效性模型中常用到的相关材料及其属性,其中骶骨、左髂骨和右髂骨使用CT图像中灰度值与材料弹性模量的数学关系的方式对其赋予材料属性[5]。
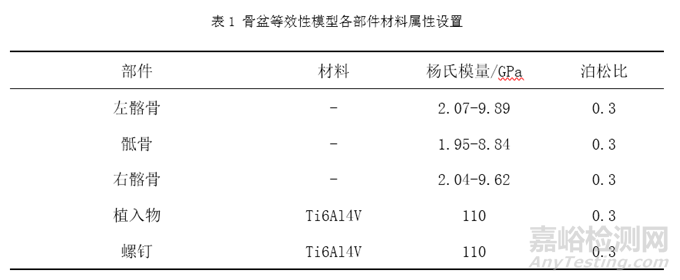
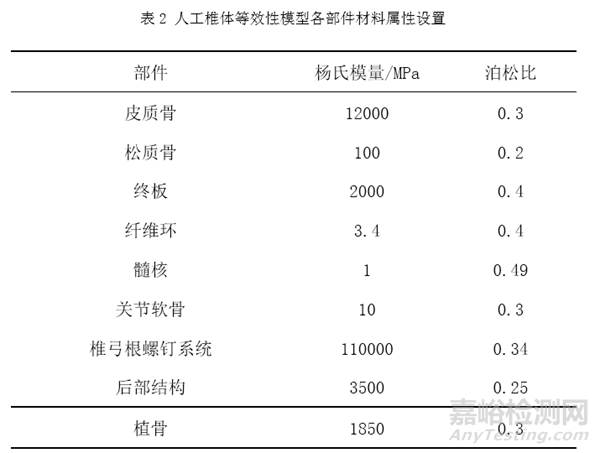
表2列举了人工椎体等效性模型中常用到的相关材料及其属性,其中椎体使用划分皮质骨和松质骨的方式对其赋予材料属性[3,6-10]。
利用3D打印技术制备的多孔结构植入物,具有复杂的多孔单元结构,其等效的材料力学性能取决于材料、工艺、单元结构形貌等诸多要素,获取此类产品局部材料力学性能时需注意采用科学的评价体系和可重复性的评价方法。建议采用同等工艺制备同等孔隙结构标准样块进行等效力学性能测试,选取相应性能参数进行孔隙结构部位力学性能赋予,进而实现以简化实心模型代替复杂多孔结构模型。对于不同多孔结构设计的植入物,需获取相应的材料参数。
(四)固定约束
等效性模型的固定约束需符合骨植入物体内的运动功能和力学性能要求,明确植入物的固定位置、方式,骨和/或软组织与植入物,植入物部件之间界面的实际约束条件。
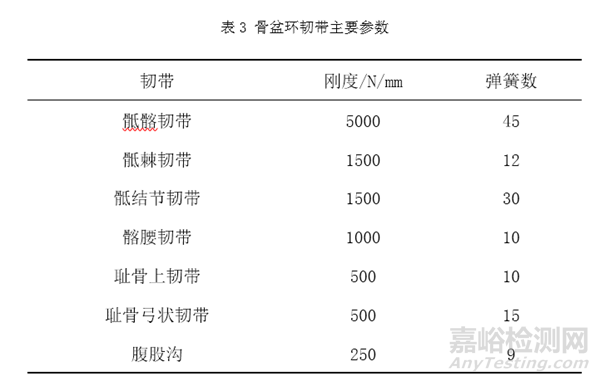
例如骨盆假体等效性模型的固定约束条件设置,一般对于老年人来说,其骶骨和髂骨间存在部分融合,仅能产生微动,所以骶骨和髂骨之间可以使用绑定接触[4,5]。在耻骨联合、髂骨和假体间,可以根据骨盆假体与其接触的人体骨间是否存在相对运动等来设置适宜的约束方式,如骨盆假体与其接触的人体骨间不存在相对运动,则可以使用绑定接触[11]。固定接触表面例如螺钉螺纹与骨接触表面以及螺钉与骨盆假体接触表面可使用绑定接触模拟螺钉的固定效果[8]。主要骨盆环韧带,如骶髂韧带、骶棘韧带、骶结节韧带、髂腰韧带、耻骨上韧带和耻骨弓状韧带,可以恒定刚度通过线性弹簧元件组添加,这些韧带的参数可参考表3[4,12]。根据Dalstra和Huiskes的研究[13],肌肉力量在骨盆模型中可以忽略不计。
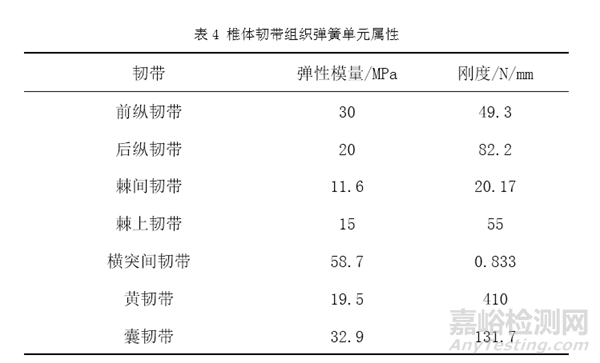
再如人工椎体等效性模型的固定约束条件设置,对于椎体关节突关节,由于软骨层的存在且摩擦系数极低,建议关节突的关节面接触采用无摩擦接触[3]。椎间盘与椎体终板紧密结合,接触部位不发生相对位移建议采用绑定接触[14]。固定接触表面例如螺钉螺纹与骨接触表面,可使用绑定接触模拟螺钉的固定效果[8]。人工椎体植入后,其与终板之间的微动可忽略,上下终板与人工椎体之间可以采用绑定接触[3]。人工椎体等效模型中包含的韧带组织可使用弹簧元件组添加,表4为椎体韧带组织对应弹簧单元的材料属性[3,6,7]。
(五)加载条件
等效的力学和运动学加载条件需尽可能模拟植入物在植入体内后所处的真实力学环境,所进行的设置以不产生错误的应力集中为基本原则。等效性模型的加载条件需与临床预期使用情况相符,优先选取典型生理活动下植入物的力学和运动学加载条件。
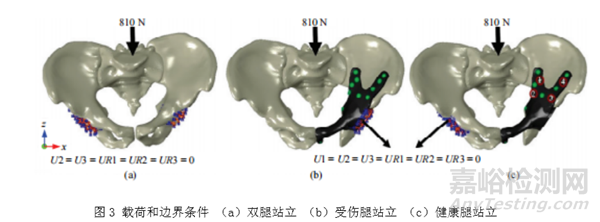
对于骨盆假体,可考虑的典型的生理活动如站立、步行、上下楼梯、下蹲、坐起等。Enchun Dong等人[5]在对定制式骨盆假体进行有限元分析时计算了骨盆的三种静态条件,即双腿站立、健康腿(右侧)站立和受伤腿(左侧)站立。该研究中加载条件和边界条件设置如下:骨盆的坐标系基于骨盆前平面(APP),X轴平行于包括左右髂前上棘在内的线,Y轴垂直于前平面,Z轴垂直于X轴和Y轴,原点位于骨盆的重心。在三种静态条件下,即双腿站立、健康腿(右侧)站立和受伤腿(左侧)站立,均从骶椎S1顶部沿骨盆纵轴施加810N(1.2*B.W)的载荷。对于双腿站立,允许两个髋臼杯上的节点自由水平平移(X方向),但其他5个自由度受到限制(图3(a));而左腿和右腿站立时,左右髋臼杯上的节点分别被完全限制在所有自由度范围内(图3(2)和(c))。
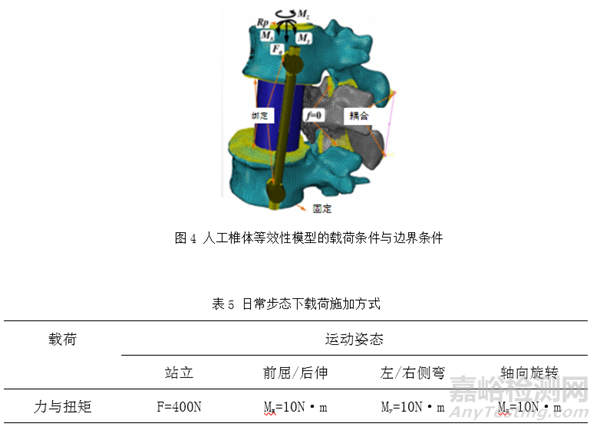
对于人工椎体,可考虑人体脊柱日常活动中多种受力状态,如站立、前屈、后伸、侧弯和旋转姿态。Wang Ling等人[3]在对人工椎体植入物进行有限元分析施加了四种载荷条件:站立、弯曲、侧向弯曲(LB)和轴向旋转,图4为该人工椎体等效性模型的载荷条件与边界条件图。如图4所示,该模型L3节段下表面全固定,通过在L1节段上表面施加竖直向下的载荷以模拟人的站立姿态。通过在L1节段上表面施加不同轴向与方向的弯矩来模拟人的前屈,后伸,左右侧弯与左右旋转的活动,具体施加载荷如表5所示。
(六)输出结果
根据等效性模型建立的目的,输出相应的评价参数进行分析。评价参数可能包括最大主应力、范式等效应力(Von Mises Stress)、变形、疲劳强度、螺钉与骨组织间的固定失效情况、微位移、骨密度分布等与植入物长期与短期的功能关系等,评价参数的选取需以能够反映植入物强度和植入后服役性能及安全性为目的。
第四部分:构建模型的验证要求
等效性模型的正确性可通过数值或者物理试验的方法进行验证,等效性模型的验证包括两个阶段:构建方法的验证和模型输出的验证。
(一)构建方法的验证
对于构建方法准确性验证,验证内容需包括但不局限于整体生物系统的等效性模型中骨植入物、骨和固定物几何形貌的输入误差敏感性验证,网格质量检查与网格尺寸敏感性分析,材料属性验证,固定约束和加载条件的验证。各验证需指出各个步骤中等效性模型设置和简化方法与实际模型的差异,并阐述其合理性。
以前述将L2节段前柱切除的脊柱肿瘤患者等效性模型为例[3],介绍网格敏感性分析验证方法:通过采用0.75、1和1.5mm的不同网格尺寸对人工椎体等效性模型划分网格,并对三种尺寸网格人工椎体等效性模型进行网格敏感性分析,结果表明该等效性模型最大范式应力的相对误差低于5%,因此,在对人工椎体等效性模型划分网格时取网格尺寸为1mm。
(二)模型输出的验证
等效性模型输出的验证可从物理试验、临床数据、数值仿真分析、文献报道等几个方面入手,或者结合使用、参考相应标准,对等效性模型评价能力进行验证,包括但不限于以下情况:
(1)结合物理试验和数值模型,针对同等输入参数在同等安装固定和力学承载条件下对比验证等效性模型输出的可靠性;物理模型中建议试验载体为新鲜尸体骨,动物骨或者人工材料,材料的选取需具有其合理性。
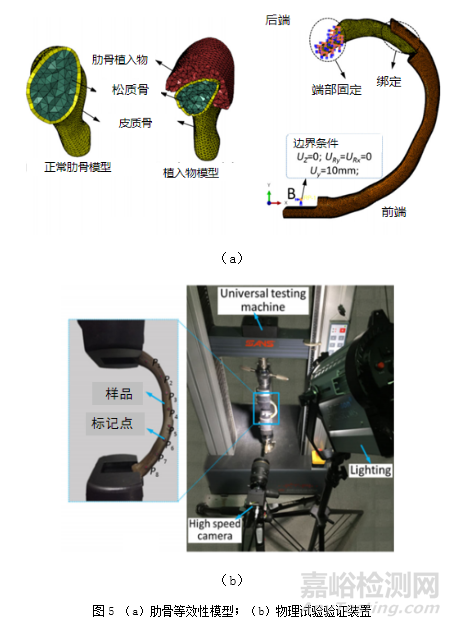
图5为文献[15]中报道的肋骨等效性模型及其物理试验验证示意图。通过对肋骨等效性模型的前端沿Y轴方向施加10mm位移载荷,得到肋骨模型的最大范式应力和位移,并对3D打印肋骨植入物在相同的加载条件下进行弯曲性能测试,通过结果比较,验证该肋骨等效性模型的合理性。
(2)针对已有临床数据的同类已上市产品,构建其等效性模型论证等效性模型输出的合理性;
(3)物理试验或数值模型的输出结果,符合类似情况文献报道的参考范围。
结语:由于3D打印医疗器械产品,尤其是定制式假体,假体一般均具有复杂的结构设计和不规则的形状,使得在植入手术前对假体的固定和生物力学有效性评价成为困难。定制式假体的生物力学研究通过常规的台架试验或简化的数学模型进行是不可能的, 通过有限元分析方法建立等效性模型去研究定制式假体的生物力学尤显重要。本文以临床中较为常见的骨盆假体、人工椎体、肋骨假体为例从模型构建的考量因素、网格划分、材料及其属性、固定约束、加载条件、输出结果、模型验证等方面论述了等效性模型构建的方法及要求,以期能够为3D打印医疗器械生产企业及监管机构未来的工作提供参考。
参考文献
[1]刘冬旭,严新谊,等.单腿站立姿态下Ⅰ+Ⅱ+Ⅲ型标准半骨盆假体生物力学研究[J].医用生物力学,2015,30(6):8-13.
[2]Taimoor Iqbal;Ling Wang; et al.A general multi-objective topology optimization methodology developed for customized design of pelvic prostheses[J].Medical Engineering and Physics,2019,69:8-16.
[3]Ling Wang;Jianfeng Kang; et al.Investigation into factors affecting the mechanical behaviours of a patient-specific vertebral body replacement[J]. Journal of Engineering in Medicine,2018,232(4):378-387.
[4]Taimoor Iqbal;Lei Shi; et al.Development of finite element model for customized prostheses design for patient with pelvic bone tumor[J].Journal of Engineering in Medicine,2017,231(6):525-533.
[5]Enchun Dong;Ling Wang; et al.Finite Element Analysis of the Pelvis after Customized Prosthesis Reconstruction[J].Journal of Bionic Engineering,2018,15(3): 443-451.
[6]Qing Hang Zhanga;Ee Chon Teo; et al.Finite element analysis of moment-rotation relationships for human cervical spine[J].Journal of Biomechanics,2006,39(1): 189-193.
[7]Ling Wang;Yingying Wang; et al.Can the sheep model fully represent the human model for the functional evaluation of cervical interbody fusion cages[J].Biomechanics & Modeling in Mechanobiology,2019,18(3):1-10.
[8]Oktenoglu T; Erbulut D U;et al.Pedicle Screw-Based Posterior Dynamic Stabilisation of the Lumbar Spine: In Vitro Cadaver Investigation and a Finite Element Study[J]. Computer Methods in Biomechanics & Biomedical Engineering, 2015, 18(11):1252-1261
[9]Hongwei Wang;Zhongjun Mo; et al. Extent and Location of Fixation Affects the Biomechanical Stability of Short- or Long-Segment Pedicle Screw Technique with Screwing of Fractured Vertebra for the Treatment of Thoracolumbar Burst Fractures:An Observational Study Using Finite Element Analys[J].Medicine,2018,97(26):e11244.
[10]Kallemeyn N; Gandhi A; et al. Validation of a C2-C7 Cervical Spine Finite Element Model Using Specimen-Specific Flexibility Data[J].Medical Engineering & Physics, 2010,32(5):482-489.
[11]郭鹏年,张占阅,等.骨盆定制假体的设计及有限元分析[J].中国骨伤,2019,32(6): 564-568.
[12]Phillips AT;Pankaj P;et al.Finite element modelling of the pelvis: Inclusion of muscular and ligamentous boundary conditions[J].Medical Engineering and Physics,2007,29(7):739-748.
[13]Dalstra M;Huiskes R. Load transfer across the pelvic bone[J].Journal of Biomechanics,1995,28(6):715-724.
[14]Alexander Tsouknidas;Stylianos Orestis Sarigiannidis;et al. Assessment of Stress Patterns on a Spinal Motion Segment in Healthy Versus Osteoporotic Bony Models with or without Disc Degeneration: A Finite Element Analysis[J].The Spine Journal,2015,15(3):17S-22S.
[15]Jianfeng Kang;Ling Wang;et al.Custom design and biomechanical analysis of 3D-printed PEEK rib prostheses[J].Biomechanics and Modeling in Mechanobiology,2018,17(4):1083-1092.

来源:Internet


