您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2024-08-06 09:27
【问】注射器包材供应商发生变更,包材材质和/或类型一致,如何开展等同性研究?
【答】根据中国医药包装协会T/CNPPA 3009—2020《药包材变更研究技术指南》,其研究过程可分为以下几个步骤:
(1)基于先验知识评估风险:若评估相关风险可接受时,可认为等同性及相容性研究完成。
(2)若评估仍存在风险,需开展进一步药包材等同性实验研究:
①结合药包材质量标准或质量协议,以及药品的性能和生产特性,评估变更前后药包材的保护性和功能性关键性能;
②评价药包材变更前后是否化学等同。
进行安全性评估:变更前后药包材化学等同,且体外细胞毒性试验可接受(玻璃等无机材料无需进行生物学试验),化学等同性研究结果可用于安全性评估;变更前后的药包材化学不等同,需先定性定量分析新增加的提取物/浸出物,再进行安全性评估(体内、体外生物学评价和可提取物/浸出物的毒理学风险评估);
进行相容性研究:化学等同性研究和安全性评估可视为相容性研究的一部分,在此基础上根据风险评估情况判断是否需开展进一步的相容性研究;对药包材的等同性及相容性研究进行总结,确定变更后药包材是否可接受。
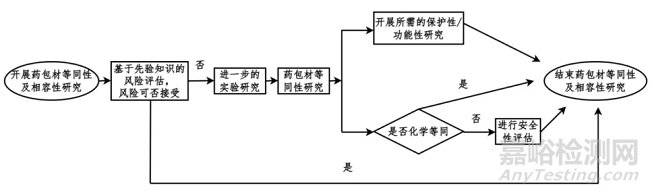
药包材等同性及相容性研究流程图
注:先验知识可能包括:组件配方(如材料组成、添加剂、工艺助剂、催化剂、抗氧剂、色素等)、材料/组件的合规性,如药典或相关标准的符合性、生物反应性试验、TSE/BSE(传播性海绵状脑病/牛海绵状脑病)声明、特殊关注物质无添加声明、化学兼容性、历史提取研究数据及安全性评估数据、组件生产工艺或预处理工艺(如灭菌、清洗、硅化、表面处理)、材料/组件在药品中的使用历史(如已获批上市制剂的处方工艺特性、临床使用信息)、药品处方工艺特性等。

来源:江苏药监


