您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2024-09-05 08:15
为先进治疗药品(ATMP)建立稳健的污染控制策略(CCS)对于确保药品的安全供应至关重要。由于大多数ATMP是非终端灭菌制剂,因此在生产过程的许多步骤中都需要进行无菌处理。这些过程与用于传统生物制药的生产过程相比,提出了独特的挑战。
本文提出了一种正式的、系统的方法,用于管理ATMP无菌加工的独特风险,即无菌风险评估模型(Aseptic RiskEvaluation Model)。
什么是无菌风险评估模型(AREM)?
ATMP生产工艺的新颖性和复杂性在评估与工艺和污染控制相关的风险时带来了明显的挑战。因此,当工艺开发的可用知识有限时(尤其是在cGMP控制环境中生产经验有限时),风险评估过程的风险识别、分析和评估步骤可能会遇阻。在评估ATMP的无菌过程中,目前常用的方法工具大多都存在主观性。从风险评估小组那里常听到“我认为这应该是分值”(表明尝试对未来的控制而不是当前状态进行评分)或“我们还没有这样做,但应该没问题”(表明在缺乏数据的情况下存在很大的偏差,并且某些组织的风险承受能力高于正常水平),这些确实表明需要一种新方法来处理这些评估事宜。
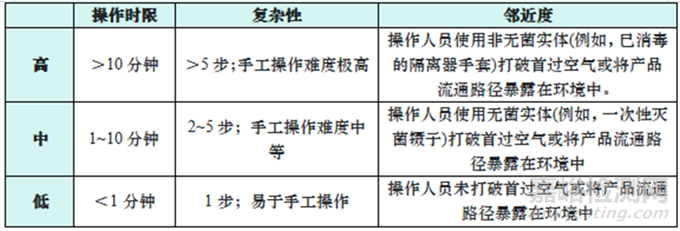
ICH Q9将风险定义为损害发生的可能性和损害的严重程度的组合。在某些情况下,风险评估方法需要评估可能性和严重性以外的参数,以便更好地了解危害的风险。无菌操作的“危害性”被定义为产品受到微生物污染,在识别风险时,该潜在危害的严重性始终被认为是“高”的。出于此,AREM工具旨在关注于无菌操作性能的参数,以及它们如何导致该生产过程受到微生物污染。在确定无菌操作的固有风险外,还有一些因素更适合帮助我们理解风险——操作时限Duration、复杂性Complexity和邻近度Proximity。
无菌风险评估模型过程
与任何质量风险评估一样,该过程从生命周期的风险启动阶段开始,通过定义风险问题,在这种情况下,可以简单地理解为:“在药品生产过程中,在无菌边界内进行的每次单独操作(无菌保证)失去无菌(无菌保证)的相对风险是多少?”
一旦您的风险问题得到提炼和透彻理解,就可以选择最适合回答该问题的风险工具和方法。像上面这样的风险问题非常适合AREM方法,完成这种基于风险的方法的简单过程可以分解为以下步骤:
第1步:基于风险的方法的前期工作
风险评估,或者在这种情况下是基于风险的方法,只有用于告知风险的信息才能发挥作用。确保适当的利益相关者参与该过程至关重要。AREM SME团队需要包括多个部门的代表,最重要的是,需要包括那些在GMP生产环境中执行无菌过程的人员。例如,SME团队可以由MSAT、生产、QA及QC组成。此外,风险评估小组队长既接受过 QRM 原则的培训,也接受过特定的 AREM 工具方法的培训,才能领导团队成员。一旦团队成立,AREM 的准备阶段就可以开始了。
范围设置是 AREM 的重要步骤,风险评估小组将在此定义无菌生产过程的边界——评估范围将从何处开始,到何处结束。通常,AREM 将涉及对产品流路径或加工物料暴露于环境或产品流路以任何方式中断的任何步骤的操作。应讨论工艺步骤(如流路的无菌焊接)是否在范围内或超出范围,并明确捕捉作为工作的假设。下面捕获了可以包含在 AREM 范围内的流程步骤或单元操作的其他示例:
可以使用AREM评估的流程步骤/单元操作示例:
· 在开放式系统中执行手动操作(B 级洁净室内的BSC)→ 在封闭系统(C级洁净室内的培养箱)中执行手动操作
· 用于制备工艺溶液(培养基)的无菌手动连接--通过0.2 μm过滤器过滤培养基
· 使用“现成的”医用管道和连接器--定制设计和灭菌的组件
· 确定在装置操作后进行过程微生物检测(例如,微生物负荷、无菌)的需求,并执行一系列高风险的工艺步骤。
最后,AREM风险评估小组应收集重要信息,以输入到记录中。在此阶段执行的最有用的活动之一是过程演示。由经验丰富的人员演示无菌操作对于整个团队的理解非常重要,从而可以更好地对风险因素进行评分。这可以通过在开发实验室甚至会议室中模拟无菌处理步骤来实现,例如,使用注射用水代替产品和工艺溶液进行无菌操作。如果有的话,来自实际生产区域的这些无菌操作的视频也可以提供信息。
第2步:确定在无菌边界内执行的所有无菌步骤
工作会议开始后要执行的第一项活动应该是确定使用该工具评估范围内的所有无菌步骤。风险评估小组应通过逐步审查每个批次记录(如果有)来执行此任务,以确定执行的每个单独的无菌操作。在预工作阶段执行的过程的演示也有助于确定此列表。
第3步:对每个因子的每个单独操作进行评分
一旦确定,每个无菌操作都需要由风险团队进行评分,以确定一个操作相对于为该过程执行的所有其他操作的相对风险。给定过程的所有无菌操作都将使用相同的标准进行评分,风险评估小组应在开始评估之前达成一致。考虑无菌操作总体风险的因素是该操作的各个方面,这些方面能够增加污染事件的可能性,或者如果引入污染物,这些因素会放大对产品或中间体的后果。在确定无菌操作的总体风险时被认为至关重要的因素可以在下表 1 中找到,各个评级标准可以在表2 中找到。
表 1:AREM 考虑的无菌操作因素

表 2: AREM 中使用的因素的风险分级
第 4 步:使用 AREM 矩阵确定每个操作的总体风险评分
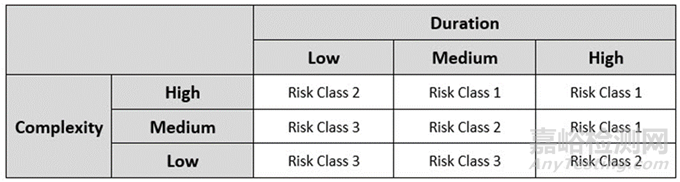
风险评估小组将能够通过将风险因素评分输入到AREM方法中来确定每个单独的无菌操作的总体风险。三因素评分需要采用双矩阵方法;第一个矩阵将复杂性和操作时限评级相结合,生成一个初始风险值),该值与邻近度评级一起输入到最终矩阵中,以确定总体风险值。用于确定初步风险值的初步 AREM 矩阵如下表 3 所示:
表 3: 用于确定初始风险等级的初步矩阵
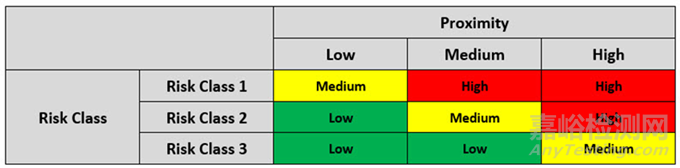
最终风险矩阵将每个无菌操作的初始风险值与其邻近评级相结合,以确定操作的总体风险值。最终的风险矩阵见下表 4。
表 4: 用于确定总体风险评分的最终矩阵
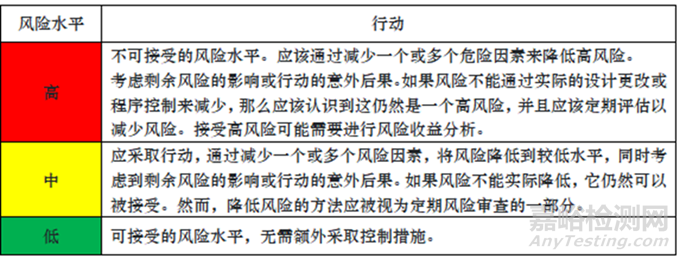
在确定总体风险评分后,将按风险对无菌程序进行排序,并采取具体措施,如表4所示。
第 5 步:确定风险可接受性和风险缓解措施(如果需要)
风险评估小组现在可以使用每个单独的无菌操作的总体风险评分来确定每个操作在风险方面的可接受性(例如,它们是否适合在此过程中执行,是否需要改进才能继续等)。为此,必须在所有评级操作中一致且统一地采用风险可接受性表。参阅下表 5,了解建议的 AREM 风险可接受性表。
表 5: 基于总体风险评分的风险可接受性表
第 6 步:AREM 的输出 – 记录评估和战略输出项目
根据风险评估结果,输出下列行动(仅举例):
(1) 通过减少不可接受的高风险操作来优化无菌工艺,而不是等待APS过程中不可避免的故障发生,甚至更糟的是,在产品生产过程中。
(2) 告知基于风险的方法对操作人员进行无菌工艺的培训和资格认定——重点关注最关键的方面,以证明执行这项重要工作的人员对无菌的适当理解。
(3) 建立适当的标准操作程序和生产批记录,用于常规cGMP生产处理。
结论
AREM风险评估工具应在生产过程的整个生命周期内进行管理。所有相对风险较高的无菌操作的进一步开发和设计可能需要时间和资源。出于这个原因,高风险步骤必须是无菌培训的重点,并且必须证明将要执行这些无菌操作的每位员工都通过了资质认定。

来源:Internet


