您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2024-10-11 09:23
医疗器械是离我们健康最近的产品,关系到我们每一位的生命安全。
同时,生产企业和注册证众多。
目前,全国范围内约有3.5万家医疗器械生产企业,持有的注册证和备案证数量更是达到了30多万张。
这一庞大的数字不仅体现了行业的繁荣,同时也给监管部门带来了前所未有的挑战。
为了确保医疗器械的质量和安全性,除了设定严格的市场准入门槛外,监管机构还实施了多样化的监管措施。
其中,对医疗器械生产企业的分级监管是一项重要的管理手段。
本篇聊聊医疗器械生产企业的分级监管方式。
No.1 上下联动监管
1). 国家药监局
a). 国家局负责指导和检查全国医疗器械生产分级监管工作;
b). 制定医疗器械生产重点监管品种目录。
2). 省药监局
a). 负责制定本行政区域医疗器械生产重点监管品种目录;
b). 组织实施医疗器械生产分级监管工作。
3). 市监管部门
负责本行政区域第一类医疗器械生产分级监管。
No.2 重点监管目录
1). 国家局制定
根据医疗器械产品风险程度,国家局制定并动态调整重点监管目录。
2). 省监管局补充
省局应当综合分析本区域同类产品注册数量、市场占有率、生产质量管理总体水平和风险会商情况等因素,对国家局制定的目录进行补充,确定本区域内医疗器械生产重点监管品种目录,并进行动态调整。
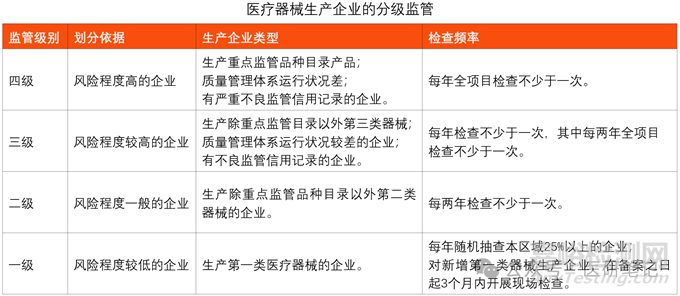
No.3 分级监管
1). 四级监管
对风险程度高的企业实施四级监管。
主要包括:生产重点监管品种目录产品;以及质量管理体系运行状况差的企业;有严重不良监管信用记录的企业。
对实施四级监管的企业,每年全项目检查不少于一次。
2). 三级监管
对风险程度较高的企业实施三级监管。
主要包括:生产除本行政区域重点监管品种目录以外第三类医疗器械;以及质量管理体系运行状况较差的企业;有不良监管信用记录的企业。
对实施三级监管的企业,每年检查不少于一次,其中每两年全项目检查不少于一次。
3). 二级监管
对风险程度一般的企业实施二级监管。
主要包括:生产除本行政区域重点监管品种目录以外第二类医疗器械的企业。
对实施二级监管的,原则上每两年检查不少于一次。
4). 一级监管
对风险程度较低的企业实施一级监管
主要包括:生产第一类医疗器械的企业。
对实施一级监管的,原则上每年随机抽取本行政区域25%以上的企业进行监督检查。
对新增第一类医疗器械生产企业在生产备案之日起3个月内开展现场检查。
No.4 动态调整监管级别
省局结合监督检查、监督抽验、不良事件监测、产品召回、投诉举报和案件查办等情况,确定监管级别并告知企业。
1). 上调监管级别的情形
a). 发生严重质量事故的企业;
b). 新增高风险产品的企业;
c). 国家带量采购中选产品的;
d). 创新方式获得注册证的企业;
e). 跨区域委托生产的医疗器械注册人;
f). 仅进行受托生产的受托生产企业。
2). 下调监管级别的情形
对于长期以来监管信用状况较好的企业。
写在最后
生产企业应当明确自己所处的监管级别,并配备相应的管理制度。
参考资料
[1]. 国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见 药监综械管〔2022〕78号.
阅读 146

来源:医研笔记


