您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 16:04
一、基本概况
1、自然环境
沙特阿拉伯(以下简称沙特)位于亚洲西部的阿拉伯半岛,国土面积225万平方公里。沙特东濒波斯湾,西临红海,同约旦、伊拉克、科威特、阿联酋、卡塔尔、阿曼、也门等国接壤,海岸线长2448公里,地势西高东低。除西南高原和北方地区属亚热带地中海型气候外,其他地区均属热带沙漠气候。夏季炎热干燥,最高气温可达50℃以上;冬季气候温和。年平均降雨不超过200毫米。
2、人口和行政区划
沙特人口约3218万,其中沙特公民约占58.4%。伊斯兰教为国教,逊尼派占85%,什叶派占15%。官方语言为阿拉伯语。
沙特全国分为13个省:利雅得省、麦加省、麦地那省、东部省、卡西姆省、哈伊勒省、阿西尔省、巴哈省、塔布克省、北部边疆省、吉赞省、纳季兰省、焦夫省。省下设一级县和二级县,县下设一级乡和二级乡。首都为利雅得(Riyadh)市,人口约700万。
3、2024年出口概况
沙特实行自由贸易和低关税政策,是二十国集团中唯一的阿拉伯国家,中国是沙特的主要贸易伙伴。2024年1-6月,中国向沙特出口医疗器械总计约18.51亿元人民币,同比上升11.26%,增势非常可观。
二、沙特医疗器械监管机构和法规要求
沙特食品药品管理局 Saudi Food and Drug Authority(SFDA)负责监管沙特阿拉伯的医疗器械注册。
监管法规如下:
◆ Medical Devices Law (Royal Decree No. (M/54)
◆ Implementing Regulation of the Law of Medical Devices (SFDA Board Decision No. (3-29-1443)
◆ Requirements for Medical Devices Marketing Authorization (MDS-REQ 1)
三、医疗器械定义
根据“Implementing Regulation of the Law of Medical Devices (SFDA Board Decision No. (3-29-1443))” Article 1,医疗器械定义为:
任何单独使用或者与其他设备结合使用的仪器、设备、器具、植入设备、体外诊断试剂或校准物、软件、用于操作医疗器械的材料以及其他类似或者相关物品,其目的是:
1. 诊断、预防、监测、控制、治疗、减轻疾病或损伤,或者补偿损伤;
2. 对解剖或生理过程的研究、替代、调节或支持;
3. 支持或维持生命;
4. 控制或辅助受孕的;
5. 用于医疗器械的消毒;
6. 通过对来自人体的样本进行体外检测,为医学或诊断目的提供信息;
7. 不是通过药理学,免疫学或代谢方法实现其主要预期作用,但却可能通过这种方式获得其本身功能上的辅助。
“Any instrument, apparatus, applied devices, implant devices, in vitro diagnostic reagent or calibrator, software, or material used for operating medical devices, any other similar or related article, intended to be used alone or in combination with other devices for diagnosis, prevention, monitoring, controlling, treatment, or alleviation of disease or injury, or for compensation for an injury; investigation, replacement, modification, or support of the anatomy or a physiological process; supporting or sustaining life; controlling or assisting conception; sterilization of medical devices; providing information for medical or diagnostic purposes by means of in vitro examination of specimens derived from the human body; and does not achieve its primary intended action by pharmacological, immunological or metabolic means, in return it may be assisted in its intended function by such means. ”
四、产品分类
◆ 分类依据
Requirements for Medical Devices Marketing Authorization Annex (5)
◆ 分类
医疗器械Rule 1-Rule 22:
① Class A, 低风险;
② Class B, 低到中风险;
③ Class C, 中到高风险;
④ Class D, 高风险。
体外诊断设备Rule 1-Rule 7:
① Class A, 对个体及群众具有低风险;
② Class B, 对个体具有中风险,及对群众具有低风险;
③ Class C, 对个体具有高风险,及对群众具有中风险;
④ Class D, 对个体及群众具有高风险。
五、注册流程
1、注册流程图

2、注册提交文件
根据Requirements for Medical Devices Marketing Authorization (MDS-REQ 1),需提交以下技术文件+ISO 13485:2016体系证书及年度审核报告+申请表+DoC(SFDA版本)+宣传册或市场推广资料(如有)+GHTF认证证书(如有):

3、注册周期及费用
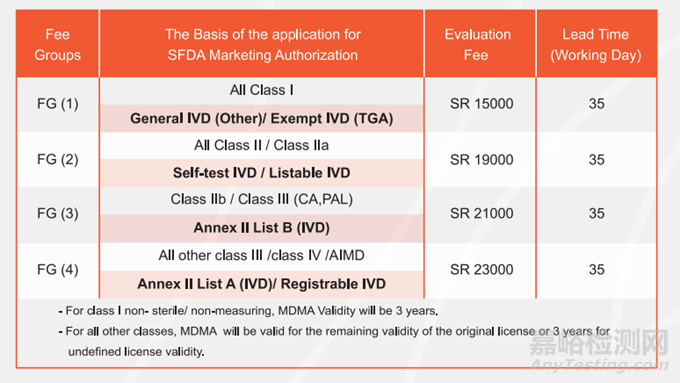
注:共有三轮发补机会,每轮补正期限为60个自然日。
4、注册证有效期
3年,到期前60天申请续证。
5、注册提交系统
通过GHAD系统在线提交所有要求的文件。自2021年7月起,本地和外国医疗器械制造商需要在新系统GHAD下注册或更新其许可证。
六、该区域有关UDI的要求
沙特已针对所有类别器械全面实施UDI要求,产品投放市场前,当地代表应将UDI-DI上传Saudi-DI数据库,如后续有变更,应于变更后十个工作日内相应更新数据库信息。
UDI上传数据库:UDI database (Saudi-DI)
出口沙特的产品必须附带UDI,认可发码机构有GS1、HIBCC及ICCBBA。实施UDI的具体要求可参考法规:MDS-REQ7 Requirments for Unique Device Identification (UDI) for Medical Devices
七、质量体系要求
A类和B类的所有医疗器械制造商、进口商和经销商应获得国家食品药品监督管理局认可的医疗器械合格评定机构(CAB)颁发的质量管理体系证书,根据沙特标准(SFDA.MD/GSO ISO 13485)或其等效标准。
C类和D类医疗器械的授权代表、进口商和经销商应提交质量管理体系应用的证据或SFDA的检验报告,以确认其符合沙特标准(SFDA.MD/GSO ISO 13485)或同等标准的质量管理体系要求。
八、沙特授权代表
◆ 授权代表(AR)必须经国家食品药品监督管理局注册并批准。
◆ 制造商可以为每个医疗器械类别或组指定不同的AR,因此需要单独的协议。
◆ 变更沙特的授权代表无需先前指定的AR参与。AR转移后无需重新注册产品。
九、特殊要求(无线认证)
沙特CITC认证是指沙特阿拉伯通信和信息技术委员会(Communications and Information Technology Commission,简称CITC)颁发的一种强制性认证,适用于在沙特阿拉伯市场销售的电信和无线设备、无线电频率设备、信息技术设备和其他相关产品。CITC认证要求产品符合沙特国家相关的技术标准和规定,通过认证后才能在沙特境内销售和使用。

来源:广东医疗器械学会