您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-12-12 18:20
一、基本概况
1、自然环境
印度尼西亚(以下简称印尼)位于亚洲东南部,国土面积1913578.68万平方公里。包括苏门答腊岛、爪哇岛、苏拉威西岛以及婆罗洲和新几内亚的部分地区。与巴布亚新几内亚、东帝汶、马来西亚接壤,与泰国、新加坡、菲律宾、澳大利亚等国隔海相望。
2、人口和行政区划
印尼人口2.81亿(2023年12月),是世界第四人口大国,约87%的人口信奉伊斯兰教,是世界上穆斯林人口最多的国家。有数百个民族,其中爪哇族人口占45%,还有巽他族、马都拉族、马来族等。官方语言是印尼语。
印尼共有一级行政区(省级)38个,二级行政区(县/市级)共514个。首都雅加达(Jakarta),常住人口1056万,是全国的政治、经济和文化中心。其他的主要经济城市包括泗水、万隆、棉兰、三宝垄和巨港等。
3、2024年出口概况
2024年1-6月,向印尼出口医疗器械总计约34.27亿人民币,同比增长约12.60%。
二、印尼医疗器械监管机构和法规要求
印尼医疗器械监管机构为卫生部(Ministry of Health, MoH)下属国家食品药物管理局(National Agency of Drug and Food Control, NADFC),亦称BPOM。
监管法规如下:
◆ ASEAN Medical Device Directive (AMDD),简称东盟医疗器械指令
◆ Regulation of the Minister of Health Number 1190/MENKES/PER/VIII/2010 on Product License of Medical Devices and Household Health Products,简称2010年第1190号法规
◆ Regulation of the Minister of Health of The Republic of Indonesia Number 62 of 2017 on Product License of Medical Devices and Household Health Products,简称2017年医疗器械、IVD及PKRT销售许可准则
三、医疗器械定义
根据Regulation No.62 of 2017 Article 1 第2条,普通医疗器械定义为:任何不含药物的器具、仪器、设备及/或植入物,旨在通过预防、诊疗、治愈和缓解疾病,以恢复患者健康,及/或重建生理结构和改善身体功能。
“Medical Devices means any instruments, apparatus, machines and/or implants that do not contain drugs used to prevent, diagnose, cure and relieve any diseases, treat sick person, recover human health, and/or form the structure of, and improve, body functions. ”
根据Regulation No.62 of 2017 Article 1 第3条,体外诊断器械定义为:可单独使用或与其他试剂、试剂盒、校准品(物)、质控品(物)、仪器、器具、设备或系统组合使用,在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中,或在血液或组织捐献与潜在接受者的安全性和相容性的确定过程中,用于对人体样本(各种体液、细胞、组织样本等)进行体外检测的试剂、试剂盒、校准品(物)、质控品(物)、仪器、器具、设备或系统等,包括样本容器。
“In Vitro Diagnostic Medical Devices means any reagent, reagent product, calibrator, control material, kit, instrument, apparatus, equipment or system, whether used alone or in combination with any other reagent,reagent product, calibrator, control material, kit, instrument, apparatus, equipment or system, that are intended by its product owner to be used in vitro for the examination of any specimen, including any blood or tissue donation, derived from the human body, solely or principally for the purpose of providing information concerning a physiological or pathological state or a congenital abnormality; to determine the safety and compatibility of any blood or tissue donation with a potential recipient, or to monitor therapeutic measures and includes a specimen receptacle. ”
四、产品分类
根据Regulation No.62 of 2017 Article 7
1、医疗器械分类
a) Class A, low risk level低风险;
b) Class B, low to moderate risk level低到中风险;
c) Class C, moderate to high risk level中到高风险;and及
d) Class D, high risk level高风险。
2、IVD分类
a) Class A, low risk level on individual and the public对个体及群众具有低风险;
b) Class B, moderate risk level on individual and low risk level on the public对个体具有中风险,及对群众具有低风险;
c) Class C, high risk level on individual and moderate risk level on the public对个体具有高风险,及对群众具有中风险;and及
d) Class D, high risk level on individual and the public对个体及群众具有高风险。
五、注册流程
1、注册流程图
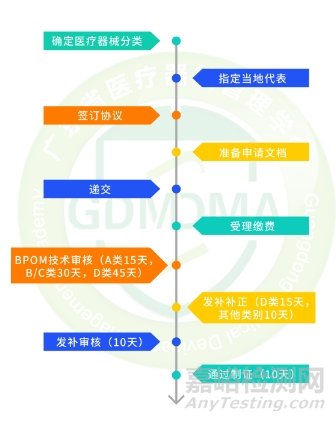
注:Product License有效期为5年,制造商与当地代表签订的协议有效期为2∼5年,如协议过效期不续签,产品证书将自动失效。
2、注册提交技术文件


特别提示:不需原产国注册,但需要自由销售证明(FSC)- 可以是非原产国主管机构出具的FSC,内容要求如下:
a) trade name/brand name;
b) type of product;
c) name and address of Manufacturer; and
d) period of validity.
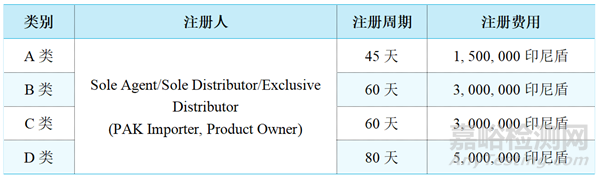
3、注册周期及费用
4、注册提交
由当地代表(注册人)通过OOS系统登录获得许可证ID,然后通过Kemenkes平台在线提交所有要求的文件。
5、当地代表
1、印尼当地代表法规术语为Sole Agent/Sole Distributor/Exclusive Distributor,外国制造商必须在印尼指定当地实体公司为授权代表,属于独代性质。
2、资质要求:注册授权书、持证人(Product Owner)协议及PAK证书(PAK license)。
3、独代变更:变更独代,需于与新独代签订协议后30天内告知BPOM;如现有独代不配合独代变更手续,则可由新独代于告知BPOM变更独代6个月后重新申请。

来源:广东医疗器械学会