您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-07 20:47
摘要
自2021 年1 月1 日《化妆品监督管理条例》施行以来,国家药品监督管理局出台了一系列配套法规文件,化妆品、化妆品新原料注册备案信息服务平台也于2021 年5 月1 日上线运行。本文整理了2021年5 月1 日至2024 年4 月30 日北京市完成技术核查的首次备案进口普通化妆品相关数据,分析了新法规体系建立后、新注册备案信息服务平台运行以来技术核查环节发现的常见问题,并提出对策建议,以推动进口普通化妆品审评工作提质增效,把好进口普通化妆品质量安全关。
Since the implementation of the Regulations on the Supervision and Administration of Cosmetics on January 1 2021 the National Medical Products Administration has issued a series of supporting regulatory documents. The registration and filing information service platform for cosmetics and new cosmetic ingredients was officially launched on May 1 2021. This article examines the relevant data on imported general cosmetics that underwent initial registration and completed technical verification in Beijing from May 1 2021 to April 30 2024. It analyzes the common issues encountered during technical verification since the establishment of the new regulatory system and the launch of the new registration and filing information service platform. It proposes countermeasures and suggestions to enhance the quality and efficiency of the evaluation process for imported general cosmetics and to ensure their quality and safety.
关键词
进口普通化妆品;备案;技术核查;常见问题;对策建议
imported general cosmetics filing technical verification common issues recommendations
2021 年1 月1 日,《化妆品监督管理条例》[1]正式施行;同年5 月1 日,《化妆品注册备案管理办法》[2] 施行。《化妆品注册备案管理办法》第十条第二款明确规定“ 化妆品、化妆品新原料注册人、备案人按照规定通过化妆品、化妆品新原料注册备案信息服务平台( 以下简称信息服务平台) 申请注册、进行备案。” 与此同时,信息服务平台于2021年5 月1 日同步上线运行。普通化妆品备案审查包括资料整理和技术核查两个环节。资料整理主要关注备案资料的规范性和完整性等方面, 而技术核查则通过全面审查备案资料,对产品的合规性和安全性进行初步判定[3] 。在备案管理工作中,技术核查作为重要的监管手段,对规范企业生产、保障消费者安全用妆具有重要意义。
本文基于信息服务平台运行以来的数据,整理了2021 年5 月1 日至2024 年4 月30 日北京市完成技术核查的首次备案进口普通化妆品相关信息,分析新法规体系建立后、新信息服务平台运行以来技术核查中的常见问题,并提出对策建议。
1、 备案产品基本概况
1.1 备案产品数量
2021 年5 月1 日至2024 年4 月30 日期间,北京市完成进口普通化妆品备案技术核查的首次备案产品共2239 件。按照使用人群分类, 普通人群备案产品2179 件,占绝大多数;而婴幼儿、儿童备案产品仅60 件(图1)。

按照作用部位分类,普通人群备案产品中数量最多的是面部产品,共1312 件( 图2);婴幼儿、儿童备案产品各分类数量差异不明显(图3)。

1.2 各类意见备案产品数量
1.2.1 普通人群备案产品各类意见数量
在普通人群备案产品中,被出具“ 备案通过”意见(以下简称A 类意见) 的备案产品197 件,占比9. 04%; 被出具“责令改正” 意见( 以下简称B类意见) 的备案产品1928 件,占比88. 48%; 被出具“责令改正并暂停生产或进口销售” 意见( 以下简称C 类意见) 的备案产品51 件,占比2. 34%;被出具“取消备案” 意见(以下简称E 类意见) 的备案产品3 件,占比0. 14% (图4)。

1.2.2 婴幼儿、儿童备案产品各类意见数量
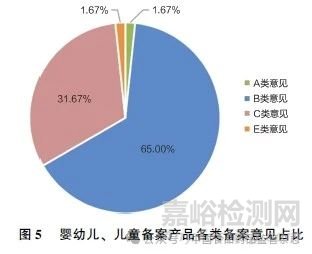
在婴幼儿、儿童备案产品中,被出具A 类意见的备案产品1 件,占比1. 67%;被出具B 类意见的备案产品39 件, 占比65. 00%; 被出具C 类意见的备案产品19 件,占比31. 67%;被出具E 类意见的备案产品1 件,占比1. 67% (图5)。
2、 技术核查环节发现的常见问题
2.1 B 类意见常见问题
2.1.1 常见问题在各项备案资料中的数量分布情况
B 类意见常见问题涉及7 项备案资料。其中,涉及备案申请表的435 条,占比7. 73%; 涉及产品名称命名依据的677 条,占比12. 03%;涉及产品配方的841 条,占比14. 95%;涉及产品执行的标准的1167 条, 占比20. 74%;涉及产品标签的1226 条,占比21. 79%;涉及产品检验报告的170 条,占比3. 02%;涉及产品安全评估资料的1111 条,占比19. 74% (图6)。

2.1.2 B 类意见在各项备案资料中的常见问题
2.1.2.1 备案申请表
分类编码项下的功效宣称、作用部位、产品剂型、使用方法与备案资料中相应内容不一致。例如,某产品宣称“改善毛发断裂分叉”, 但在功效宣称项下填写的是“护发”, 未填写“防断发”。
2.1.2.2 产品名称命名依据
产品通用名和属性名的归属不符合《化妆品标签管理办法》[4] 的相关要求, 以及未说明中文名称和外文名称的对应关系。例如, 某产品中文名称为“某凝胶膏”, 命名依据中对“ 凝胶” 的说明为“ 该产品为透明状, 形似凝胶”, 但是将“凝胶” 填写在了通用名中。
2.1.2.3 产品配方
对配方表中填写的原料需要进一步说明的,未在配方表备注栏中予以标注。例如,某产品配方表中填报了两个原料,名称相同,均为“透明质酸钠”,但未在配方表备注栏简要标注分别填报的原因;另有产品配方中有原料“ 黄芩( Scutellaria baicalensis)提取物”,但未在配方表备注栏说明原植物的具体使用部位。
配方表使用目的栏填写的内容不符合要求。例如,某产品功效宣称为“抗皱”,且产品中文名称中有原料名称“胶原蛋白”,但产品配方中原料“水解胶原” 的主要使用目的却标注为“皮肤调理剂”,与产品功效宣称不相符。
2.1.2.4 产品执行的标准
2.1.2.4.1 生产工艺
常见问题包括生产工艺简述未体现主要生产工艺参数范围、生产工艺分组未体现配方中所有原料,以及生产工艺过程未包含所有分组。例如,某产品生产工艺简述中有多个原料混匀的步骤, 但是未体现原料混匀时的温度控制参数;某产品配方有45 个原料,而生产工艺分组中只有44 个原料;某产品生产工艺分组为A 组~F 组,但生产工艺过程中仅出现A 组~D 组。
2.1.2.4.2 感官指标
使用贴、膜类载体材料的产品未分别描述贴、膜类材料以及浸液的颜色、性状等;未明确液体、啫喱是否透明。例如,某使用膜类载体材料的面膜产品填写的颜色为“淡黄色”,性状为“黏稠液体附着在白色无纺布上”, 但未分别描述膜类材料和浸液的颜色、性状。
2.1.2.4.3 微生物指标和理化指标
常见问题包括4 个方面:未按照《化妆品安全技术规范》[5] 的要求设置微生物指标范围,如某眼部产品的菌落总数指标设置范围为“ ≤1000CFU/g”,而《化妆品安全技术规范》中要求眼部产品的菌落总数限值为≤500CFU/g;微生物指标名称不规范, 如某产品的检验项目填写为“ 霉菌和酵母菌”,而规范名称应为“霉菌和酵母菌总数”;未针对产品实际情况设置指标控制范围, 如某非防晒类产品使用了化学防晒剂“ 二苯酮-4”,但其理化指标中对“二苯酮-4” 的指标控制范围设置为“ 总量≤5%(以酸计) ”, 未按照配方中的实际添加量设置指标控制范围;对于采用检验方式作为质量控制措施的产品, 所用检验方法与《化妆品安全技术规范》所载方法不一致的,未说明该方法是否与《化妆品安全技术规范》所载方法开展过验证。
2.1.2.5 产品标签
常见问题主要体现在以下几点:产品使用方法与原包装中相应内容不一致;安全警示用语未按照《化妆品安全技术规范》的要求标注;未按照原包装宣称勾选“其他特别宣称” 中的相应内容;原包装中宣称的原料功效、产品功效未在中文标签中体现;销售包装中容易误导消费者或者消费者不易理解的内容未在中文标签中解释说明。例如, 某产品配方原料中有“水杨酸”,但未按照《化妆品安全技术规范》的要求标注安全警示用语;某产品中文名称中有原料名称,未勾选“ 特定宣称( 原料功效) ”;某产品宣称“8 小时保湿”,未勾选“宣称量化指标的(时间、统计数据等) ”。
2.1.2.6 产品检验报告
检验报告内容不符合要求。例如,某产品的境内责任人地址与备案信息不一致, 但未予以说明,也未提交检验报告变更申请表和检验检测机构出具的补充检验报告或者更正函;又如,某产品毒理学试验项目检验报告积分均值为整数,未保留两位小数。
上传无关检验报告。例如,《化妆品注册备案资料管理规定》[6] 中规定了产品检验报告包括微生物与理化检验、毒理学试验、人体安全性试验报告和人体功效试验报告等,但是某产品将产品保湿检验报告(非人体试验) 上传至该项下。
2.1.2.7 产品安全评估资料
摘要中的适用部位与备案申请表、产品标签中的相应内容不一致;对原料的安全评估依据不足;未对原料中可能含有的风险物质进行正确的识别与评估。例如,某产品中的特定原料缺乏可供参考的权威机构、本企业原料历史使用量或最高历史使用量的评估依据,评估该原料的安全性时未按照《化妆品安全评估技术导则(2021 年版) 》[7] 有关毒理学研究的要求进行急性毒性、局部毒性以及系统毒性的完整评估。
2.2 C 类意见常见问题
2.2.1 常见问题在各项备案资料中的数量分布情况
C 类意见常见问题涉及4 项备案资料。其中,涉及产品配方的3 条,占比4. 29%; 涉及产品执行的标准的1 条, 占比1. 43%;涉及产品检验报告的15 条,占比21. 43%;涉及产品安全评估资料的51条,占比72. 86% (图7)。

2.2.2 C 类意见在各项备案资料中的常见问题
C 类意见常见问题主要集中在产品检验报告项和产品安全评估资料项。产品检验报告项的问题为未提交产品的毒理学试验报告, 也未提交所在国家(地区) 政府主管部门出具的生产质量管理体系相关资质认证文件。产品安全评估资料项的问题为未提交符合《化妆品安全技术规范》要求的、针对原料中存在的风险物质的质量规格证明文件。例如,某产品配方中有原料“矿脂”, 但未提供由原料生产企业出具的质量证明资料,用来说明其“ 熟悉其精炼过程, 不含致癌物质”。又如,某产品配方中有《化妆品安全技术规范》对其有限制要求的着色剂,但未提供由原料生产企业出具的该着色剂的质量规格证明文件。
2.3 E 类意见的问题
2.3.1 问题在各项备案资料中的数量分布情况
在本研究期间, 共出具E 类意见3 条,分别涉及备案申请表、产品配方和产品标签各1 条。
2.3.2 E 类意见在各项备案资料中的问题
备案申请表项的问题为通过产品名称判断提交备案的产品不属于化妆品备案范围。例如,某产品名称显示适用于孕妇和哺乳期妇女,不属于普通化妆品备案范围。
产品配方项的问题为系统中填报的产品配方与生产工艺简述中的原料、检验机构盖章的配方及安全评估资料中的配方不一致,无法判断备案资料的真实性。例如,某产品在系统中填报的配方含有22个原料, 但生产工艺简述中的原料、检验机构盖章的配方及安全评估资料中的配方均显示有29 个原料,且两者原料均不相同,无法判断备案资料的真实性。
产品标签项的问题为通过标签宣称判断提交备案的产品不属于化妆品备案范围。例如,某产品根据其使用方法和原包装中的宣称可判断该产品是改善因色素沉积导致痘印的产品,属于祛斑美白类产品,不属于普通化妆品备案范围。
3、 问题分析与对策思考
3.1 问题分析
自2021 年5 月1 日《化妆品监督管理条例》施行以来, 国家药品监督管理局出台了一系列配套的法规文件。这些文件在助力加强化妆品监管的同时也对监管部门、技术审评机构和境内责任人/备案人提出了更高的要求。
北京市2021 年5 月1 日至2024 年4 月30 日期间完成技术核查的首次备案进口普通化妆品常见问题的相关数据表明,自《化妆品监督管理条例》施行3 年来,境内责任人/ 备案人对该条例及其配套法规文件的理解掌握仍有待提高,特别是在产品标签、产品执行的标准、安全评估资料等关键领域的要求上存在较大改进空间。此外,数据还显示, 婴幼儿、儿童产品的备案通过率仅为1. 67%, 显著低于普通人群产品9. 04%的备案通过率;同时,婴幼儿、儿童产品被出具C 类意见的比例为31. 67%,远高于普通人群产品的2. 34%。这些差异表明,婴幼儿、儿童产品应作为技术核查的重点,其安全性问题亟需重视。境内责任人/备案人应进一步加强对儿童产品备案资料相关法规要求的理解。
出现上述问题,反映出化妆品备案工作中境内责任人/ 备案人主体责任意识不强,落实主体责任不到位,未能全面理解和落实“ 对提交的注册备案资料的合法性、真实性、准确性、完整性和可追溯性负责” [6]。此外, 备案人员对相关法律法规的学习深度不足,对其内容的理解和实际操作的掌握不到位。
3.2 对策建议
3.2.1 强化境内责任人/备案人主体责任
境内责任人/备案人应积极整理总结技术审评机构出具的意见,有针对性地加强对相关法律法规的学习和理解, 提高备案资料的质量。
对于备案资料中出现的规范性问题, 境内责任人/备案人应加强对《化妆品注册备案资料管理规定》相关内容的学习。对于备案资料出现问题较多的产品标签、产品执行的标准、产品安全评估资料等项目,应深入学习《化妆品标签管理办法》《化妆品安全技术规范》《化妆品安全评估技术导则(2021年版) 》,以及中国食品药品检定研究院分别于2024 年4 月30 日、2024 年7 月8 日发布的与完整版安全评估相关的通知公告[8-12] 等相关内容。对于儿童化妆品,还应加强《儿童化妆品技术指导原则》[13] 相关内容的学习。此外, 为进一步强化主体责任意识、提升合规能力,境内责任人/ 备案人应深入学习《化妆品监督管理条例》《化妆品注册备案管理办法》和《企业落实化妆品质量安全主体责任监督管理规定》[14] 等法规文件。
3.2.2 进一步提升政府监管效能
一是技术审评机构加大对企业的培训力度。技术审评机构可通过多种形式,深入了解企业在备案工作中遇到的实际问题, 有针对性地开展培训活动。例如, 通过走访企业、开展实地调研及定期组织线下座谈会等方式, 听取境内责任人/备案人的意见,收集和梳理共性问题及困惑。针对共性问题开展专题培训,从而有效提升境内责任人/备案人提交备案资料的质量。
二是加强各部门间的交流互通、数据共享和协同联动。技术核查作为备案产品政府备案后监管的关键一环,其作用不应该是孤立的。通过探索技术核查与其他备案后监管手段之间的协作机制,可有效提升技术核查的科学性和靶向性。例如,将抽样检验数据、不良反应监测数据与技术核查对接,将每年化妆品抽样检验不合格产品及出现不良反应的产品涉及的境内责任人/ 备案人提交的备案产品纳入技术核查重点范围, 进而提高技术核查的科学性和靶向性。
3.2.3 充分发挥行业协会的桥梁纽带作用
一是充分发挥行业协会的职能作用,当好政府的参谋助手,切实反映境内责任人/备案人的愿望和需求。
二是搭建备案管理部门和境内责任人/备案人之间的沟通交流平台。通过建立备案交流互通长效机制,推动进口普通化妆品备案技术核查工作提质增效。
3.2.4 其他建议
为提高备案工作的规范性和效率,提出以下建议。
一是由国家药品监督管理局相关部门统一审核尺度,使境内责任人/备案人能够更准确地把握备案资料的要求和标准。
二是明确B 类意见的改正期限。通过设立具体的时限规定, 确保逾期未改正的备案产品能够被依法取消备案,以此提高境内责任人/备案人对B 类意见改正的重视, 并促使其及时改正完成。
三是进一步完善信息服务平台功能。①设置短信提醒功能。向境内责任人/备案人即时发送完成技术核查意见的消息, 提醒境内责任人/备案人及时查看意见并落实改正措施。②考虑设置改正期限倒计时提醒功能。在普通化妆品备案的资料整理环节,平台设有5 个工作日整理完成的倒计时提醒功能。在技术核查环节设置改正期限倒计时提醒, 可以帮助审核人员实时掌握改正期限剩余时间,改正期限到期时,能够及时将境内责任人/备案人未完成改正的产品取消备案。
4、 结语
化妆品产业的高质量发展,离不开监管部门和从业者的共同努力。本文通过梳理进口普通化妆品技术核查环节中出现的问题,分析其原因并提出对策建议。通过强化境内责任人/备案人主体责任、提升政府监管效能、发挥行业协会的桥梁纽带作用,以及完善信息服务平台功能等多维措施,推动进口普通化妆品审评工作提质增效,把好进口普通化妆品质量安全关,推动新时代化妆品产业迎来新发展、取得新成效。
引用本文
孙雅洁,张海峰,李锐,于春媛∗.北京市进口普通化妆品备案技术核查常见问题分析及建议[J/OL].《化妆品与皮肤科学》网络专刊,2024(3):1-7[2025-01-16].https://www.cfdam-health.com/ebook/hzp/202403/index.html.

来源:中国食品药品监管杂志


