您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-09-20 09:10
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
罗氏Gazyva获突破性疗法认定。罗氏开发的CD20抗体Gazyva获FDA授予治疗狼疮性肾炎的突破性疗法认定。Gazyva是一款对抗体Fc片段进行糖基化改造的抗CD20抗体,它具有更好的清除外周和组织中B细胞的能力。一项Ⅱ期临床NOBILITY结果显示,Gazyva与标准疗法联用(霉酚酸酯或霉酚酸,和皮质类固醇),在一年内肾脏达到完全缓解的患者比例显著高于对照组,达到试验的主要终点。Gazyva同时达到关键性次要终点。此外,Gazyva还显示出良好的安全性。详细数据将在未来的医学会议上公布。
国内药讯
1.景峰医药替罗非班一致性评价获受理。景峰医药旗下盐酸替罗非班氯化钠注射液的一致性评价申请获国家药监局受理。该产品为抗血小板凝集药,主要用于末次胸痛发作12小时之内且伴有ECG改变和/或心肌酶升高的非ST段抬高急性冠脉综合征(NSTE-ACS)成年患者,预防早期心肌梗死。用于计划进行直接PCI的急性心肌梗死患者(STEMI)以减少重大心血管事件的发生。该注射液应与普通肝素和阿司匹林一起使用。据悉,抗血栓药物2016年市场规模超过194亿元,其中,抗血小板药物市场规模约115亿元。
2.安科生物醋酸阿托西班原料药申报生产获批准。安科生物全资子公司苏豪逸明制药的醋酸阿托西班原料药获国家药监局批准在上市制剂使用。阿托西班是一种缩宫素与加压素V1A联合受体拮抗剂,其化学结构和二者相似,且与受体有高度亲和性,竞争性结合缩宫素和加压素V1A受体,从而阻断缩宫素和加压素的作用途径,减少子宫收缩。醋酸阿托西班注射液临床上主要用于推迟即将来临的早产。目前,该产品原料药申报生产共有2家药企获批。
3.以岭药业阿那曲唑片拟纳入优先审评。以岭药业旗下阿那曲唑片的4类仿制药上市申请拟纳入优先审评公示名单。优先审评理由:该品为美国共线品种,已获FDA批准上市。阿那曲唑为一种强效、选择性非甾体类芳香化酶抑制剂,用于绝经后妇女的晚期乳腺癌治疗及早期乳腺癌辅助治疗。该药原研药由ANI Pharmaceutical开发,最早于1995年在美国获批上市。据统计,阿那曲唑片2018年全球销售额为3.76亿美元,中国市场全终端销售额约为12.63亿元。
4.科济生物公布CAR-T产品最新随访结果。科济生物在IMW 2019会议上公布其CT053全人抗BCMA CAR-T细胞治疗复发/难治多发性骨髓瘤的最新随访结果。截止2019年6月30日,24例受试者的中位随访时间为333天,总缓解率为87.5%,完全缓解为79.2%。其中12例受试者持续处于完全缓解,中位随访时间为383天。≥3级治疗相关的不良事件主要为预期的血液学毒性。15例(62.5%)受试者发生细胞因子释放综合征(CRS)均为1-2级。发生1例3级可逆转的神经毒性。CT053的整体耐受性良好。目前,CT053正在中国进行注册临床研究。该疗法本月初已获FDA授予的孤儿药资格。
5.君实生物冲刺“新三板+港交所+科创板”。君实生物拟在科创板上市通过上海证监局辅导验收。该公司有望成为中国首家“新三板+H+科创板”的生物医药公司。同日,君实生物宣布其PD-1抗体特瑞普利单抗(拓益)单药治疗经标准治疗失败后的晚期局部进展或转移性膀胱尿路上皮癌患者的临床试验(POLARIS-03研究)完成最后一例患者入组。拓益此前已获批用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤,自2月底上市销售至6月30日,拓益实现销售收入3.08亿。据悉该公司已开展11项临床评估拓益用于鼻咽癌、非小细胞肺癌、三阴性乳腺癌等癌症的疗效。
6.阿斯利康拿下令泽舒在中国的独家商业化权益。阿斯利康宣布与Ironwood公司就双方关于利那洛肽(商品名:令泽舒)的合作协议做了修订并达成共识。根据最新协议约定:阿斯利康获得利那洛肽在中国大陆、香港和澳门的独家开发、生产和商业化权利。利那洛肽是全球首个鸟苷酸环化酶激动剂,今年1月在中国获批用于治疗便秘型肠易激综合症(IBS-C)成人患者。根据协议,阿斯利康将分三期向Ironwood支付总额为3500万美元的固定款项。此外,Ironwood还有可能获得最高9000万美元的销售里程碑付款。
国际药讯
1.强生IL-23抑制剂Tremfya提交新适应症申请。强生旗下杨森公司选择性IL-23抑制剂Tremfya(guselkumab)的新适应症申请已向FDA提交,用于活动性银屑病关节炎(PsA)成人患者的治疗。该公司计划年底也向欧洲药管局(EMA)提交该新适应症申请。Tremfya此前已获FDA批准用于治疗中重度斑块型银屑病成人患者。III期临床研究(DISCOVER-1和DISCOVER-2)数据显示,治疗24周后。2项试验均达到ACR20缓解的主要终点,研究中观察到的Tremfya的安全性与之前研究一致。详细结果将在未来的医学会议上公布。Tremfya目前也正开发用于克罗恩病、溃疡性结肠炎等其他自身免疫性疾病的治疗。
2.诺和诺德索马鲁肽公布两项Ⅲ期数据。诺和诺德公布索马鲁肽两项Ⅲ期临床积极数据。SUSTAIN 8试验结果显示,索马鲁肽能将患者的平均糖化血红蛋白(HbA1c)水平降低1.5%,优于活性对照组(1.0%),患者未接受治疗前的基线水平为8.3%;索马鲁肽组中66.1%的患者的HbA1c水平达<7%的目标,而对照组这一数值为45.1%;索马鲁肽组中22.3%的患者体重降低>10%,对照组这一数值为8.9%。SUSTAIN 10试验数据显示,索马鲁肽能将HbA1c水平平均降低1.7%,优于利拉鲁肽(1.0%),患者基线水平为8.2%;索马鲁肽组80%的患者HbA1c水平<7%,利拉鲁肽组为46%;索马鲁肽在降低体重方面也优于利拉鲁肽。
3.OncoCell MDx公司完成B轮融资。OncoCell MDx公司完成2220万美元的B轮融资。OncoCell MDx是一家泛疾病免疫基因组学平台公司。该公司开发了比较来自特定受试者的吞噬细胞和淋巴细胞的基因组技术,作为一种机制来过滤与可能影响基因表达的疾病引起的扰动不相关的基因组序列。与其他液体活检测试相比,该公司的新型无创血液检测可以促使与健康基线或参考状态有各种偏差的受试者的识别和分群。本轮资金将用于支持其检测技术的开发和商业化,用于多种癌症以及其他疾病,并计划明年上市一款侵袭性前列腺癌检测和评估的活检产品。
4.Novaremed完成一笔新的融资。生物制药公司Novaremed宣布完成260万瑞士法郎融资(未公布具体轮次)。Novaremed成立于2008年,是一家临床阶段的生物制药公司。该公司正在开发一种口服非阿片类小分子药物NRD.E1,具有治疗糖尿病神经性疼痛(DNP)的作用机制。该药物Ⅱa期临床试验显示,经NRD.E1治疗的患者疼痛显著减少。Novaremed目前正准备在全球范围进行Ⅱb期研究,预计将于2020年第二季度或第三季度开始。
5.Atomwise达成两项合作。基于人工智能技术的药物设计公司Atomwise宣布,它通过分别与SEngine Precision Medicine和OncoStatyx公司合作,创立了两家合资企业。Atomwise公司成立于2012年,其核心技术AtomNet是一种基于深度学习神经网络的虚拟药物发现平台技术。AtomNet拥有使用强大的深度学习算法和计算能力,可通过分析数以百万计的潜在新药数据来设计药物。与SEngine Precision Medicine的合作将使用从患者体内获得的细胞培养的活体肿瘤类器官(organoid)模型,检测个体化药物分子的疗效。与OncoStatyx的合作将开发三阴性乳腺癌相关蛋白的靶向抑制剂。
医药热点
1.20年来7种癌症生存率报告出炉。一项由国际癌症研究机构(IARC)领导的名为高收入国家癌症生存项目的调查报告在线发表于《柳叶刀·肿瘤学》上。该研究统计1995年-2014年期间高收入7个国家7种常见癌症的生存情况进展。7种常见高发癌症为:食管癌、胃癌、结肠癌、直肠癌、胰腺癌、肺癌和卵巢癌。数据显示,20年来,7种常见癌症生存率均有所增加。结直肠癌的预后最好,5年生存率约60%-70%;其次为卵巢癌,5年生存率约35%-45%。最“夺命”的仍为号称“癌症之王”的胰腺癌,大多数国家的5年生存率不足10%。
2.银川互联网医院将门诊大病纳入医保。银川市发布《银川市医疗保险门诊大病互联网医院管理服务办法(试行)》,将原来只能在实体医疗机构(线下)诊治的门诊大病就诊方式扩展到互联网医院(线上),主要解决患者便捷就医的问题,同时通过银川先行先试为全区乃至全国示范。据了解,适用病种先行从高血压、糖尿病试行,建立门诊大病线上医疗费用支付制度。本办法自2019年10月1日施行,试行期一年。
3.河南下放护士执业注册审批权。河南省卫健委下放护士执业注册审批权限,护士执业注册(含首次、变更、注销注册等)机关为省辖市、省直管县(市)、县(市、区)级卫健行政部门,护士执业注册工作按照医疗机构管理权限实行分级管理。其中,在省级卫健行政部门进行执业登记的医疗卫生机构,注册机关为所在地省辖市级卫健行政部门。2008年5月12日前已取得护士执业证书和2008年前取得护理专业技术资格证书并从事护理工作的人员换领护士执业证书由省级卫健行政部门负责。
【微芯生物】抗II型糖尿病国家1类新药西格列他钠片新药上市申请(NDA)获得受理。
审评动向
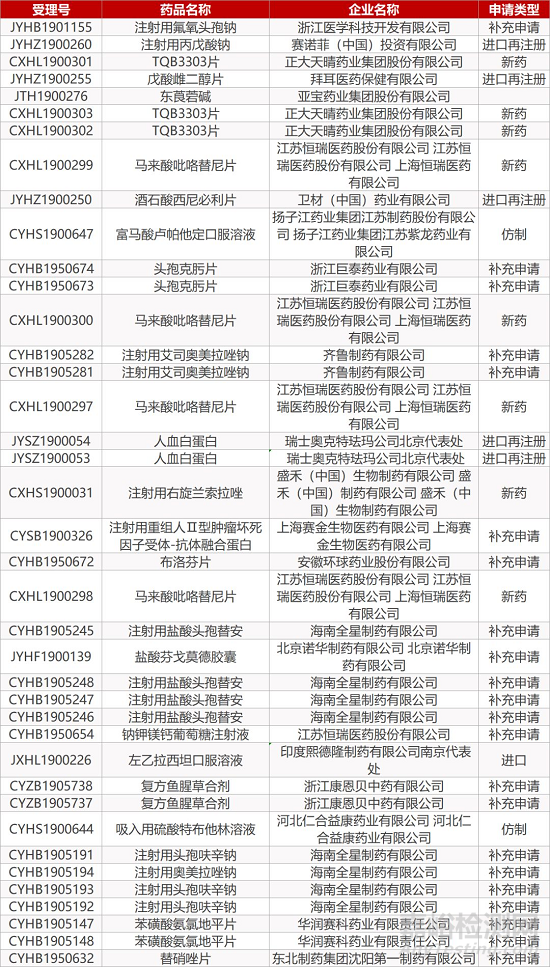
1. CDE最新受理情况(09月19日)
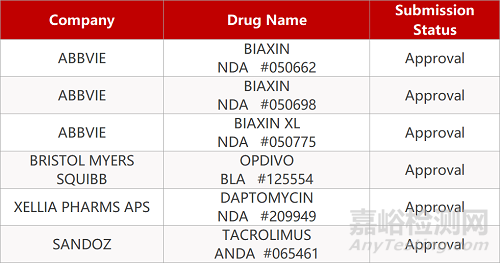
2. FDA最新获批情况(北美09月18日)

来源:药研发


