您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-15 18:34
改盐是新药研发的优化过程,根据具体品种的不同特点,可能在化合物开发早期开展,也可能在临床研究阶段、甚至是上市后进行。已上市药物的改盐曾经占我国新药研发很大比例,这是技术水平较低时难以避免的现象。随着制药工业的发展进步,药物的改盐工作更多地从上市后优化前移到上市前研发中。
小分子创新药物盐基优化的研究评价,应考虑不同盐基对化合物本身性质以及药理毒理特性影响,对药物的安全性、有效性以及质量进行科学判断。盐基的不同一般不会引起主体化合物药理作用机制的改变,但可能通过改变主体化合物药动学过程而改变其药理作用的强度。药理作用强度减弱会影响药物的有效性,而药理作用强度增强可能会产生毒性反应。此外,在药学方面,小分子化合物可能因盐基的不同而存在理化性质的差异。对于改盐药物的研究评价,应以药动学(PK)研究为主线,关注改盐前后带来的PK 差异,进而分析可能带来的有效性、安全性方面的差异,同时结合药学特性的改变,整体评估盐基改变给新药开发带来的风险获益。
本文基于实际审评案例,从盐基对化合物理化性质、化合物非临床有效性和安全性的影响进行分析,总结经验,完善对小分子创新药物研发中盐基优化工作的认识。
1、改盐与药动学特征
小分子化合物多以离子形式进入体内发挥药理作用,盐基在原理上不会影响化合物本身的作用机制,但可能影响化合物进入体内的过程。在某些情况下,不同盐基形式化合物的PK 特征存在较大差异。
化合物F 的早期开发中,对8 种不同盐基形式进行了非临床PK 比较,结果见表1。结果显示,8种不同盐基形式在小鼠体内的暴露量和相对生物利用度最大差别均接近2 倍; 峰浓度(Cmax) 最大差别超过3 倍; 达峰时间( Tmax) 最短为15 min,最长为4 h; 且暴露量、达峰时间和峰浓度未见明显关联性。
上述结果显示,不同盐基形式的化合物非临床PK 特征存在较大差异,且这种差异未见明显规律性,因此判断化合物盐基改变后PK 的变化还需依据实际实验的结果。
盐基可能通过影响化合物的溶解度,从而改变化合物进入体内的效率。化合物盐基改变引起PK变化,最终可能会体现在药效学和毒理学上。此类品种需要配合药效学和毒理学的信息,判断化合物盐基改变后的有效性和安全性以及最终盐基选择的合理性。
2、盐基与药效学
虽然化合物的有效性验证主要在临床试验阶段进行,非临床有效性试验的阴性结果也并非中止创新药物研发的充分条件,但是药物的有效性是新药研发的最终目的,对化合物有效性的考虑贯穿创新药物研发的始终。化合物不同盐基形式药效学的差异,是创新药物盐基选择时应始终关注的科学问题。
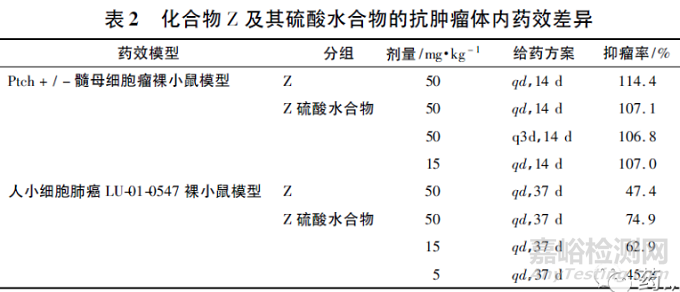
化合物Z,在不同药效学模型中比较本身及其硫酸盐形式的抗肿瘤活性,数据见表2。结果可见,在Ptch +/ - 髓母细胞瘤裸小鼠模型中,Z 硫酸水合物15 和50 mg·kg - 1剂量的抗肿瘤活性相近,与化合物Z 50 mg·kg - 1的抗肿瘤活性也接近,因此Z 硫酸盐15 mg·kg - 1的剂量可能已处于化合物Z 药效的平台期,硫酸根对药效的影响并未完全体现。结合人小细胞肺癌LU-01-0547 裸小鼠模型,Z 硫酸水合物50 mg·kg - 1 的抑瘤活性( 74. 9%)高于化合物Z( 47. 4%) ,硫酸根提升了化合物Z 的抗肿瘤活性。由于硫酸根并不存在体内的抗肿瘤活性,因此化合物Z 硫酸盐抗肿瘤活性提高很可能是化合物Z 的PK变化引起的,可能硫酸盐的存在提高了化合物Z的体内暴露量。后续需要PK 数据进一步验证。
结果显示,在不同裸鼠移植瘤模型中,在不同给药方案下,化合物Z 硫酸盐( 15 mg·kg - 1 ) 均表现出与化合物Z( 50 mg·kg - 1 )相近的抗肿瘤活性。一般而言,抗肿瘤药物的药效活性与其系统暴露量相关,如果有相关的PK/PD 数据,将更有利于评价改盐对于药效作用的影响。
在创新药物的研发过程中,申请人会针对化合物的非临床有效性的差异,结合安全性及药学方面的信息,综合考虑,选择希望较大的化合物盐形式进行下一步的研发。因此,在研发过程中并不是所有盐形式都会有完整的安全有效性资料。对于最终上市的盐基形式,应注意进行相应的完整的非临床研究。
3、盐基与安全性
安全性的考察在非临床研究中相对开展较晚,因此一个化合物可能有多种盐基形式需要进行安全性方面的评估。在安全性评价过程中,需要通过不同盐基形式的安全性比较,结合有效性和药学方面的信息,最终确定往前推进的品种。
化合物T 作为抗胆碱剂拟用于慢性阻塞性肺病的治疗,雾化吸入给药。化合物T 以二磷酸盐和柠檬酸盐的形式进行了安全药理学、单次给药毒性、重复给药毒性和遗传毒性试验。在探索性毒性试验、安全药理学试验、重复给药毒性试验、遗传毒性试验以及Ⅰ期临床试验中,使用的是二磷酸盐形式。在单次给药毒性试验以及静脉注射给药和皮下注射给药探索试验中,使用二磷酸柠檬酸形式。在重复给药毒性试验以及准备进行的Ⅲ期临床试验中,使用柠檬酸盐形式。在非临床研究的早期,使用化合物T 的二磷酸盐的形式,而在Ⅲ期临床试验开始前,确定最后的剂型为化合物T 柠檬酸的形式。该品种由二磷酸盐改为柠檬酸盐的原因在于重复给药毒性试验中的毒性差异。在大鼠28 d 重复给药毒性试验中,化合物T 二磷酸盐990 μg·kg - 1·d- 1剂量组出现喉部坏死,包括会厌和甲状腺软骨伴中度炎症,无明显损害作用水平( NOAEL) 为100 μg·kg - 1·d - 1。在犬28 d 重复给药毒性试验中,化合物T 二磷酸盐1 030 μg·kg - 1·d- 1 以上剂量组出现喉部溃疡,NOAEL为284μg·kg - 1·d - 1。而在化合物T 柠檬酸盐的大鼠和犬28 d 重复给药毒性试验中,剂量分别达到1 120 和1 310 μg·kg - 1·d- 1 时,均未见喉部的病理学变化。化合物T 柠檬酸盐在重复给药毒性试验中的安全性要高于二磷酸盐。因此,选择化合物T 的柠檬酸盐进行后续的非临床研究和临床试验。
4、盐基与药学特性
化合物的盐基不仅可以通过溶解度、生物利用度影响到化合物进入体内,最终影响化合物的药效或者毒性,还能够引起化合物药学性质的改变。在创新药物研发中,药学、非临床有效性、非临床安全性的评价可能会同步进行,因此,盐基引起的化合物药学性质改变,也是创新药物研发盐基选择时需要关注的一面。
化合物G 作为抗糖尿病药物开发,在研发早期采用游离碱进行非临床研究,后期改为盐酸盐进行研究,非临床PK 采用G 游离碱,安全性试验中游离碱和盐酸盐均有使用,具体研究项目见表3。为综合分析化合物G 游离碱和盐酸盐的试验结果,进行了桥接试验,结果显示,大鼠经口给予化合物G 相同剂量盐酸盐和游离碱后暴露量相近,犬盐酸盐组平均暴露量低于游离碱,可能由于盐酸盐组犬呕吐所致。盐酸盐和游离碱给药后暴露量均随剂量线性增加。口服盐酸盐大鼠绝对生物利用度为26%( 游离碱为34% ) ,犬为( 12. 8 ± 8) %[游离碱为( 13. 4 ~ 14)± 6%],化合物G 盐酸盐生物利用度略低于游离碱。基于桥接试验结果,化合物G盐酸盐和游离碱的PK 特征未见明显差异,化合物G 选择盐酸盐进行下一步开发的理由并不充分。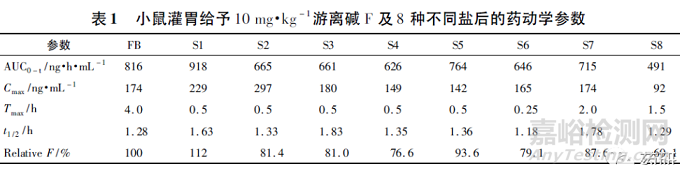
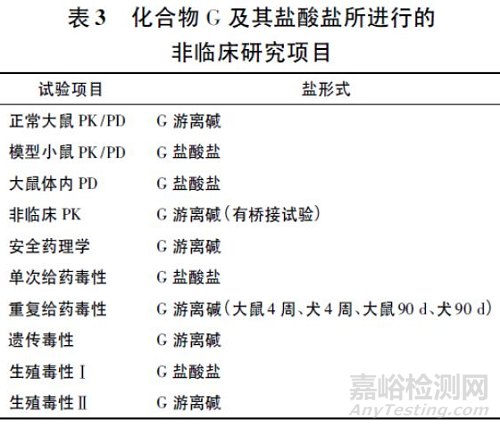
申请人提供的进一步说明显示,最先开发化合物G 游离碱完成了1 和3 个月的重复给药毒性试验,并进行了3 项Ⅰ期临床试验研究,但同时进行的药学试验结果表明化合物G 游离碱的长期加速稳定性结果不理想,因此开始研究化合物G 不同的盐型,最后拟定采用盐酸盐形式,并提供了化合物G盐酸盐的PK 和重复给药毒性试验资料,见表4。

5、改盐的其他情形
创新药物的研发既是一项科学活动,也是一种商业行为。创新药物研发项目的推进不仅需要考虑科学问题,也会受到非科学因素的影响。在评价这类项目时,需要分清科学问题和非科学因素,明确立题,遵循药物研发的规律,进行科学判断。
化合物P 为抗肿瘤化合物,原研申请人首先以游离碱形式进入临床试验。后另一申请人申请化合物P 的羟乙基磺酸盐的临床试验。提供了化合物P游离碱和羟乙基磺酸盐的PD 对比试验、PK 对比试验、单次给药毒性对比试验、重复给药毒性对比试验( 7 d) 和遗传毒性试验的资料。结果未见化合物P羟乙磺酸盐和游离碱在PK/PD 和毒性上的明显差异。从提交的非临床研究资料来看,该品种改盐的立题并不明确。化合物P 改为羟乙基磺酸盐后既未增加药效,也未减轻毒性。
原研在研发过程中曾经尝试但最终放弃了化合物P 的羟乙基磺酸盐形式。原研P 游离碱FDA的审评资料显示,化合物P 的非临床PD,PK 和安全性试验中采用了化合物P 盐酸盐、羟乙基磺酸盐以及游离碱等形式,早期Ⅰ/Ⅱ期临床试验采用化合物P羟乙基磺酸盐的形式进行,然后以化合物P 游离碱和羟乙基磺酸盐进行了生物利用度试验,最终以化合物P 游离碱形式进行后续临床试验并最终上市。P 游离碱在早期临床试验中使用羟乙基磺酸盐原料药的手工灌装胶囊,但羟乙基磺酸盐原料药具有黏性,粉末流动性差,需要手动填充至胶囊,不适用于商业化生产。因此,后期研发中对化合物P 的盐基进行了全面的筛选,发现固态无水游离碱原料药为最优形态( 流动性/稳定性) ,适用于Ⅲ期临床试验/后续商业化大生产,最终在Ⅱ/Ⅲ期临床研究中均改用游离碱为药用形式,并最终上市。
羟乙基磺酸盐申请人此前已经调研过原研公司产品P 的专利信息,也了解到化合物P 羟乙基磺酸盐可能流动性不好的问题,但经比较,认为化合物P羟乙磺酸盐具有较好的流动性,且稳定性和溶出度方面并无不良趋势,在非临床研究中也对比了化合物P 羟乙磺酸盐和碱基形式的PD,PK 和毒性,发现两者并无明显差异。因此认为,原研厂家选择游离碱开发可能主要是因为专利问题,化合物P 游离碱晶型专利的保护期比其羟乙磺酸晶型专利的保护期长约10 年。该申请人仍坚持选择化合物P 羟乙磺酸盐的开发,说明会在后期进一步考察该品种商业化大生产的可行性。
对于这种非科学因素驱动的改盐情况,评价时仍应把握科学的原则,分析品种的安全有效性。在新的审评审批改革理念下,改良型新药强调需要体现优势和临床价值[5]。新药临床试验申请的药理毒理方面审评主要关注安全性问题,有效性问题待临床试验阶段验证。因此,批准该品种临床试验,批件中提醒申请人慎重考虑改变盐基的合理性与必要性,强调后期申报生产时应提供相关证据证明该品种的优势和临床价值。
6、结语
新药研发是一个对化合物的认识不断深入、风险不断释放、药物不断优化的过程。药物研发的各个阶段,包括早期研究、非临床开发、临床试验等,均可能需要开展改盐工作。改盐工作的研究评价应把握PK主线,必要时进行桥接研究。根据新药研发不同阶段的要求,综合各方面信息,整体考虑化合物开发的风险与收益。改盐最终目的是优化药学特性,提高药效,降低毒性。改盐优化后的优势和价值最终应该在药物的安全性、有效性和质量可控性方面得以体现。

来源:Internet


