您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-13 09:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
BI尼达尼布两项新适应症在华申报上市。勃林格殷格翰(BI)宣布,国家药监局受理其乙磺酸尼达尼布软胶囊(维加特®)用于治疗进行性纤维化性间质性肺疾病(PF-ILD)适应症的注册申请。这是继今年6月其用于治疗系统性硬化病相关间质性肺疾病(SSc-ILD)适应症在华实现注册申请全球同步递交之后同年度的第二次突破。在III期临床INBUILD®研究中,尼达尼布将PF-ILD患者的用力肺活量年下降率减缓了57%。在III期临床SENSCIS®研究中,尼达尼布可减缓SSc-ILD患者的用力肺活量年下降率,延缓SSc-ILD患者的疾病进程。
国内药讯
1.吉利德丙肝药“吉四代”Vosevi即将获批。吉利德(GLD)丙肝药Vosevi上市申请已处于"在审批"状态,预计本月获批上市。"吉四代"Vosevi由索磷布韦(400mg)、维帕他韦(100mg)和伏西瑞韦(100mg)组成,相比于"吉三代","吉四代"适用的丙肝患者群体为先前用含有NS5A抑制剂方案治疗失败的基因型1、2、3、4、5或6型成年患者,以及先前使用含有Sofsbuvir但无NS5A抑制剂方案失败的基因型1a或3型成人患者。2017年7月,Vosevi已获FDA批准用于治疗无肝硬化(肝病)或轻度肝硬化的1-6型慢性丙肝(HCV)成年患者。
2.安进PCSK9抑制剂瑞百安新适应症获批。安进宣布,其降脂药物瑞百安(依洛尤单抗注射液)已于2019年11月22日获批更广泛适应症,成为中国首个获批用于成人原发性高胆固醇血症(包括杂合子型家族性高胆固醇血症)和混合型血脂异常患者的PCSK9抑制剂。此前,瑞百安已于2018年7月在中国获批,用于成人或12岁以上青少年的纯合子型家族性高胆固醇血症;并于2019年1月28日获批用于已有动脉粥样硬化性心血管疾病的成人患者,以降低心肌梗死、卒中以及冠脉血运重建的风险。
3.石药索拉非尼申报上市。石药集团提交的甲苯磺酸索拉非尼片上市申请已获国家药监局受理,受理号为CYHS1900834。甲苯磺酸索拉非尼片为多激酶抑制剂,能够抑制肿瘤细胞的生长,临床用于治疗不能手术的晚期肾细胞癌及远处转移的原发肝细胞癌。该药原研药为拜耳的多吉美(Nexavar),2018年全球销售额为7.12亿欧元。据米内网数据,2018年中国公立医疗机构终端甲苯磺酸索拉非尼片销售额超过10亿元,国内仅有原研产品获批上市。目前,药友制药、山香药业、亚宝药业、石药欧意等4家企业提交的索拉非尼上市申请处于“在审评审批中”。
4.亚盛医药抗耐药白血病新药HQP1351临床进展。亚盛医药在ASH年会上公布其1类新药HQP1351的I期临床积极结果。HQP1351是第三代BCR-ABL酪氨酸激酶抑制剂(TKI)。该项研究在TKI耐药的慢性髓性白血病(CML)慢性期(CP)或加速期(AP)患者中评估HQP1351的疗效与安全性,共入组11个剂量组(1mg递增到60mg),最终确定60mg QOD为剂量限制性毒性剂量, 50mg QOD为最大耐受剂量(MTD),40mg QOD为II期临床推荐用药量(RP2D)。中位随访时间为12.8个月(1.2~31.5),CP患者的18个月无进展生存率(PFS)为94%,AP患者为61%。
5.广生堂乙肝创新药GST-HG131临床申请获受理。广生堂1类创新药GST-HG131临床试验申请获国家药监局受理。GST-HG131是一种具First-in-Class潜质的乙肝表面抗原(HBsAg)抑制剂,拟用于治疗乙肝患者。据悉,GST-HG131能够诱导HBV-RNA降解,快速大幅降低HBsAg水平,且具有良好的安全性,是广生堂乙肝功能性治愈“登峰计划”重要组合方案之一。GST-HG131核心化合物已申请PCT国际专利,其中国专利已获得授权。
国际药讯
1.HER2靶向ADC疗法达Ⅱ期临床终点。阿斯利康和第一三共联合开发的靶向HER2的抗体偶联药物(ADC)[fam-] trastuzumab deruxtecan(DS-8201),在治疗HER2阳性转移性乳腺癌关键性Ⅱ期试验DESTINY-Breast01中达主要终点。在平均接受过6种前期疗法的患者中客观缓解率(ORR)达到60.9%,疾病控制率(DCR)达到97.3%。中位缓解时间(DOR)为14.8个月,中位无进展生存期(PFS)为16.4个月。目前该疗法已获授予优先审评资格。
2.HER2特异性TKI达到Ⅲ期临床终点。Seattle公司HER2特异性口服酪氨酸激酶抑制剂tucatinib,联合标准疗法曲妥珠单抗和卡培他滨,在治疗HER2阳性转移性乳腺癌关键性Ⅲ期试验HER2CLIMB中达主要终点和关键性次要终点。与活性对照组相比,tucatinib三联疗法显著提高患者的无进展生存期(中位PFS:7.8个月vs 5.6个月),将疾病进展或死亡风险降低46%;改善患者的总生存期(中位OS:21.9个月vs17.4个月),将患者死亡风险降低34%。在脑转移患者亚组中,三联疗法也显示出优秀的PFS,Seattle Genetics公司计划明年第一季度向FDA递交其新药申请。FDA此前已授予tucatinib用于治疗携带脑转移瘤的乳腺癌患者的孤儿药资格。
3.IL-31受体抑制剂获FDA突破性疗法认定。Galderma公司开发的“first-in-class”IL-31受体α单克隆抗体nemolizumab获FDA授予突破性疗法认定,用于治疗结节性痒疹(PN)。据悉,Nemolizumab抗体可通过与IL-31受体α相结合来阻断IL-31的信号通路。IL-31是导致严重瘙痒的重要细胞因子。在一项治疗中重度PN的Ⅱ期研究中, 与安慰剂相比,Nemolizumab不仅达到主要终点——显著改善患者的峰值瘙痒数值评定量表(PP NRS)评分,而且根据研究者全球评估(IGA)的测量,患者皮肤病变也得到显著改善。
4.吉利德与Kiniksa公司达成研发合作。吉利德旗下Kite公司的CAR-T疗法Yescarta,拟与Kiniksa公司在研抗GM-CSFRα全人源单克隆抗体mavrilimumab,联合开展评估治疗复发或难治性大B细胞淋巴瘤安全性的临床研究。mavrilimumab是一款拟用于治疗巨细胞动脉炎的GM-CSF抑制剂,目前正处于Ⅱ期临床阶段。在许多研究中,人们发现CAR-T疗法会诱导GM-CSF的产生。临床前的数据表明,干扰GM-CSF通路,有望减少CAR-T疗法带来的炎症反应,而不会影响其抗肿瘤效果。
5.罗氏奥马珠单抗新适应症在美国进入审查。罗氏与诺华联合开发的靶向抗体药物Xolair(omalizumab,奥马珠单抗)的新适应症上市申请获FDA受理,用于对鼻内皮质类固醇治疗不佳的18岁及以上成人患者,治疗鼻息肉。FDA预计在明年第三季度做出审查决定。2项III期临床(POLYP 1,POLYP 2)结果显示,与安慰剂组相比,Xolair治疗组患者在治疗24周内NPS(鼻息肉评分)和NCS(鼻充血评分)相对基线均表现出统计学意义的显著改善。2项研究中,Xolair的耐受性良好,其安全性与先前治疗中重度过敏性哮喘和慢性特发性荨麻疹患者的研究结果一致。
6.ImmunOs新型靶向免疫疗法步入临床。ImmunOs公司完成1500万瑞士法郎(约1520万美元)的A轮融资,本轮融资由辉瑞风险投资基金和BioMedPartners领投。该轮融资主要用于支持该公司治疗实体瘤和血液肿瘤的潜在免疫新疗法iosH2进入临床阶段,以及推进其它候选药物的临床前开发计划,扩大其iosH新型免疫疗法平台。ImmunOs公司新一代癌症免疫疗法可以用一个分子靶向多种受体,以激活免疫细胞之间产生抗肿瘤的协同效应,还可以重塑肿瘤微环境以增强现有免疫疗法的疗效。ImmunOs公司目前已有3款候选药物处于临床前开发阶段,分别为iosH2,iosH5和iosH1。
医药热点
1.北京发布年度体检统计报告。《北京市2018年度体检统计报告》发布。《报告》指出,在2018年中高考体检中,异常指标检出率排在前五位的是视力不良、身高不足、肥胖、超重、体重过轻。其中,青少年视力不良问题突出,中考体检视力不良检出率为81.1%,高考体检视力不良检出率为89.5%。中考体检肥胖率从2013年的12.6%上升到2018年的13.9%,高考体检肥胖检出率由2013年的13.1%上升到2018年的15.7%。在健康体检方面,异常指标检出率排名靠前的是血脂异常、超重和脂肪肝等慢性非传染性疾病相关的高危因素。
2.上海暂停四个药品挂网采购资格一年。上海市医药集采事务管理所发布《关于暂停部分自费药品挂网采购资格的通知》,从2019年12月11日起,天成药业注射用磷酸肌酸钠、奥鸿药业小牛血清去蛋白注射液、葵花药业羚羊角颗粒、扬子江药业双花百合片4个药品将暂停挂网采购资格一年。上海表示,此次决定是基于《关于进一步完善本市自费药品挂网采购工作的通知》(沪药事〔2017〕29号)中的规定,因为这些药不符合自费药品挂网的相关要求。其中注射用磷酸肌酸钠和小牛血清去蛋白注射液属于国家重点监控药品。
3.卫健委:做好地方病管理工作可获公卫补助。国家卫健委发布《关于印发地方病患者管理服务规范和治疗管理办法的通知》。《通知》提出,对基层医疗卫生机构承担的健康管理服务工作,根据工作数量、工作质量和满意度绩效评价后予以相应的补助。据了解,2019年基本公共卫生服务项目新增19项内容,其中一项就是地方病防治工作。地方病主要包括大骨节病、克山病、氟骨症、克汀病和II度甲状腺肿大5种病。给患者要提供的5项服务包括信息管理、随访评估、健康体检、干预与管理、健康教育等。
股市资讯
【景峰医药】控股子公司Sungen Pharma, LLC向美国FDA申报的安非他命混合盐口服缓释胶囊获美国ANDA批准文号,ANDA号:212037。该药用于治疗注意力不足过动症、嗜睡症以及极端的肥胖症等。
【人民同泰】1)公司与关联企业哈药营销开展采购药品的日常关联交易业务,预计追加交易金额为人民币8,550.00万元。2)公司控股股东哈药股份将以色列梯瓦的硫酸氢氯吡格雷片的中国区(除香港、澳 门和台湾)独家销售代理权授权给公司全资子公司哈药医药公司使用,本次交易构成关联交易。
【中源协和】公司拟以不超过35000.00万元的闲置募集资金暂时补充流动资金,使用期限自董事会审议通过之日起不超过12个月。
审评动向
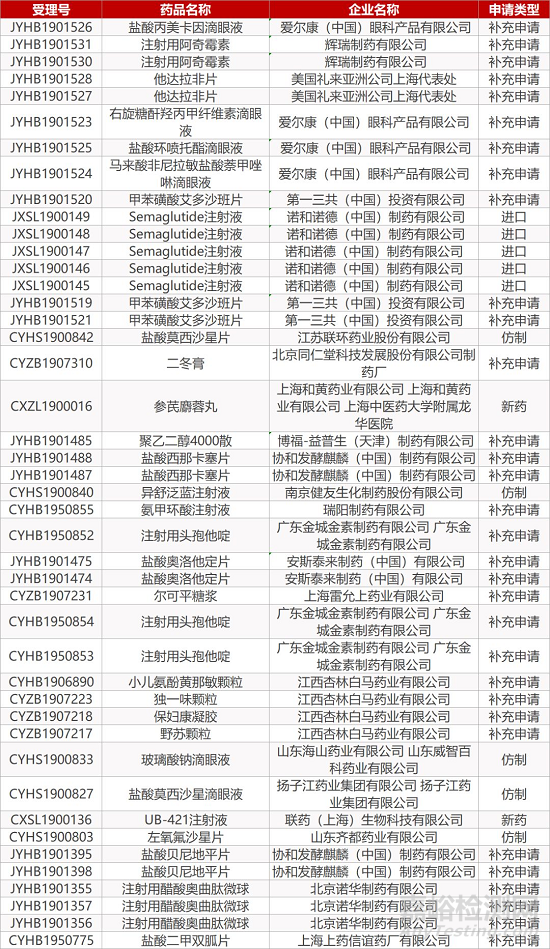
1. CDE最新受理情况(12月12日)
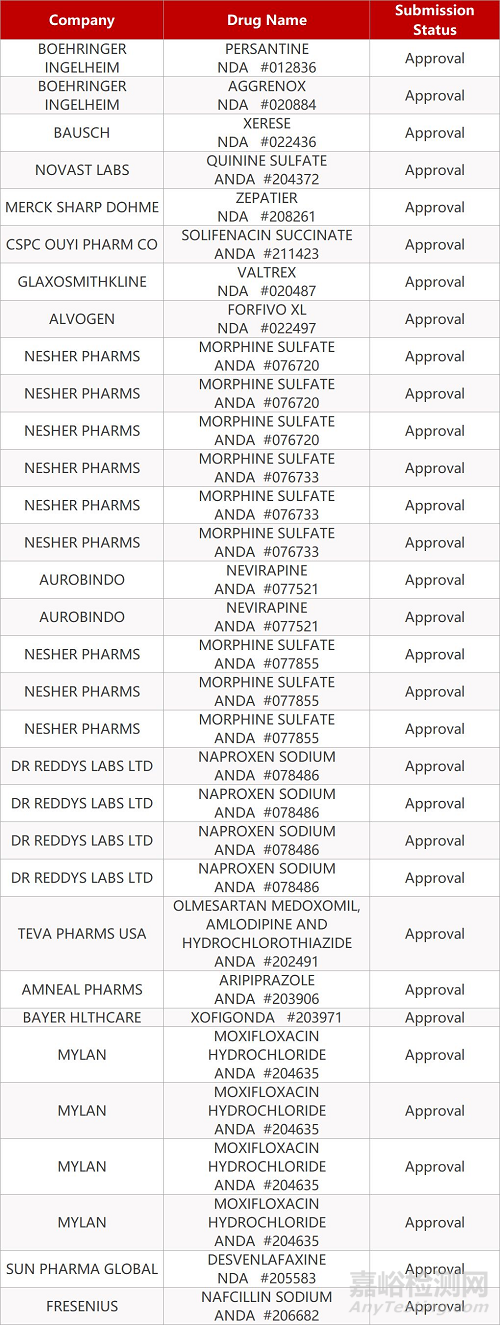
2. FDA最新获批情况(北美12月11日)

来源:药研发


