您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-02-13 18:35
阿尔茨海默病(Alzheimer's disease,AD),作为一种中枢神经系统退行性病变,是老年期痴呆的最常见类型。随着全球人口老龄化的加剧,AD的发病率呈逐年上升趋势,给家庭、社会和医疗系统带来了沉重的负担。据相关数据显示,全球约有 5000 万 AD 患者,预计到 2050 年,这一数字将突破 1.5 亿。目前,虽然尚无能够完全治愈 AD 的药物,但科研人员在药物研发领域不断探索,取得了一系列令人瞩目的进展。本文将对 AD 药物研发的最新进展进行详细梳理,分析其中的挑战,并展望未来的发展方向。
1. AD 的发病机制
AD 的发病机制极为复杂,目前尚未完全明确。主流的发病机制假说包括β - 淀粉样蛋白(Aβ)级联假说、tau 蛋白过度磷酸化假说、神经炎症假说等(图1)。
Aβ 级联假说:Aβ 的异常聚集是 AD 发病的核心事件。Aβ 是由淀粉样前体蛋白(APP)经β - 分泌酶和γ - 分泌酶依次切割产生。正常情况下,Aβ 以单体形式存在,具有一定的生理功能。然而,在 AD 患者大脑中,Aβ 会异常聚集形成寡聚体和纤维状沉淀,这些沉淀会破坏神经元之间的突触连接,引发神经毒性,导致神经元死亡,进而出现认知功能障碍[2]。
Tau 蛋白过度磷酸化假说:tau 蛋白是一种微管相关蛋白,主要功能是维持微管的稳定性。在 AD 患者大脑中,tau 蛋白发生过度磷酸化,导致其与微管的结合能力下降,微管解聚,从而破坏神经元的轴突运输,最终导致神经元功能障碍和死亡。
神经炎症假说:AD 患者大脑中存在慢性炎症反应。Aβ 聚集和 tau 蛋白异常会激活小胶质细胞和星形胶质细胞,释放多种炎症因子,如白细胞介素 - 1β(IL - 1β)、肿瘤坏死因子 - α(TNF - α)等,这些炎症因子进一步损伤神经元,加重 AD 的病理进程。
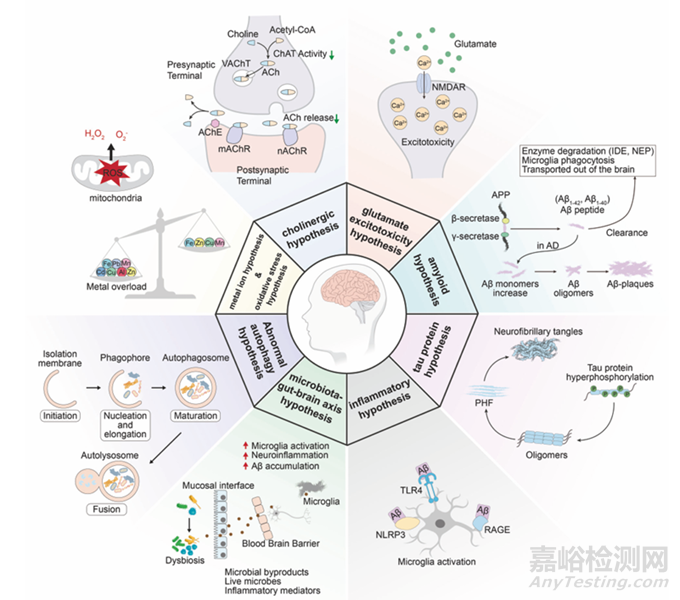
图1.AD发病机理图[5]
2. AD 药物研发的现状
目前,临床上用于治疗 AD 的药物主要有两类(图2):胆碱酯酶抑制剂和 N -甲基- D -天冬氨酸(NMDA)受体拮抗剂。其中胆碱酯酶抑制剂,如多奈哌齐、卡巴拉汀和加兰他敏,通过抑制乙酰胆碱酯酶的活性,减少乙酰胆碱的水解,从而提高大脑中乙酰胆碱的水平,改善 AD 患者的认知功能和日常生活能力。这类药物主要用于治疗轻、中度 AD 患者,对早期症状有一定的缓解作用,但不能阻止疾病的进展;NMDA 受体拮抗剂,如美金刚,则通过调节谷氨酸能神经传递,阻断 NMDA 受体过度激活导致的钙离子内流,从而减轻神经元的兴奋性毒性损伤。美金刚主要用于治疗中、重度 AD 患者,可在一定程度上改善患者的认知功能和行为症状。
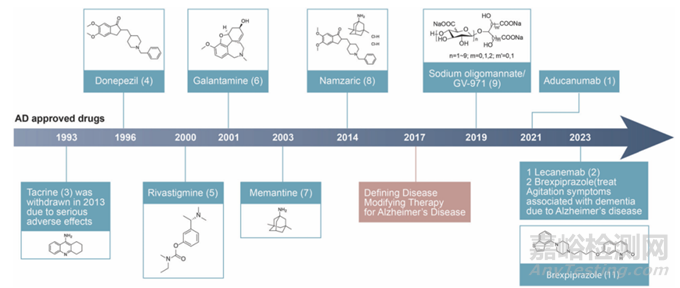
图2.FDA/中国批准治疗AD的药物[5]
处于临床试验阶段的药物主要分为Aβ靶向药物、tau蛋白靶向药物和神经炎症靶向药物三大类(图3)。
Aβ靶向药物:
(1)阿杜卡那单抗(Aducanumab):这是一款备受瞩目的 Aβ 单抗药物。2021 年,FDA加速批准阿杜卡那单抗用于治疗 AD。该药物能够特异性结合 Aβ 寡聚体和纤维状沉淀,促进其清除。多项临床试验表明,阿杜卡那单抗可以减少大脑中 Aβ 的沉积,在一定程度上改善患者的认知功能。然而,其临床疗效也存在争议,部分研究认为其改善效果有限,且存在一定的副作用,如淀粉样蛋白相关影像学异常(ARIA),包括 ARIA - E(水肿)和 ARIA - H(出血)等。
(2)仑卡奈单抗(Lecanemab):同样是一种针对 Aβ 的单克隆抗体。2023 年,FDA 批准仑卡奈单抗上市。它能够与 Aβ 原纤维结合,阻止其进一步聚集形成有毒性的寡聚体和纤维状沉淀。在临床试验中,仑卡奈单抗显示出显著的降低大脑 Aβ 水平的效果,且在认知功能改善方面也有一定的积极作用,同时相较于阿杜卡那单抗,其副作用的发生率相对较低。
(3)β-分泌酶抑制剂:这类药物通过抑制β - 分泌酶的活性,减少 Aβ 的产生。例如,BMS - 986111 等药物正在进行临床试验。然而,开发β - 分泌酶抑制剂面临诸多挑战,如药物的选择性和安全性问题。由于β - 分泌酶在体内还有其他生理功能,抑制其活性可能会导致一些不良反应。
Tau 蛋白靶向药物
(1)单抗类药物:一些针对 tau 蛋白的单克隆抗体正在研发中,如 AADvac1 等。这些药物旨在通过与 tau 蛋白结合,抑制其聚集和毒性,促进其清除。初步的临床试验结果显示出一定的治疗潜力,但仍需要更多的研究来验证其疗效和安全性。
(2)tau 蛋白激酶抑制剂:通过抑制参与 tau 蛋白磷酸化的激酶,减少 tau 蛋白的过度磷酸化。例如,GSK - 3β 抑制剂等在临床前研究中表现出对 tau 蛋白磷酸化的抑制作用,但在临床试验中的效果仍有待进一步观察。
神经炎症靶向药物
(1)抗炎药物:一些非甾体类抗炎药(NSAIDs)在早期的研究中显示出对 AD 的潜在治疗作用。例如,布洛芬等药物能够抑制炎症因子的产生,减轻神经炎症。然而,大规模的临床试验结果并不一致,部分研究未能证实其显著的临床疗效。
(2)小胶质细胞调节剂:如 PBT2 等药物,通过调节小胶质细胞的功能,减少炎症因子的释放,从而减轻神经炎症。目前,这些药物处于不同的临床试验阶段,其疗效和安全性仍在评估中。
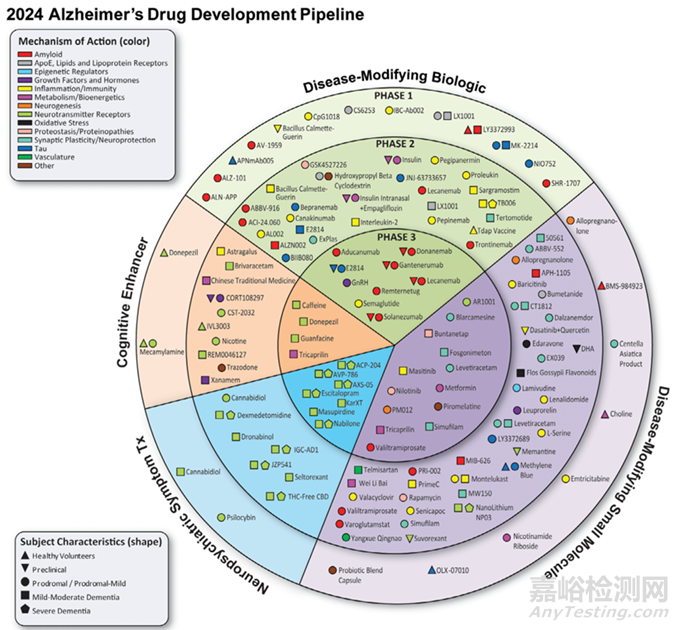
图3.治疗AD的临床试验中的药物[6]
3. AD药物研发挑战和未来发展方向
AD 药物研发是一个充满挑战但又极具前景的领域。尽管目前已经取得了一些进展,但距离找到完全治愈 AD 的药物仍有很长的路要走。在未来的研发过程中,需要深入研究 AD 的发病机制,解决临床试验中的困难,提高药物的安全性和耐受性。同时,精准医学、联合治疗、早期诊断和干预以及创新药物靶点和技术等方向将为 AD 药物研发带来新的希望。相信在科研人员的不懈努力下,未来能够开发出更有效的 AD 治疗药物,为全球数百万 AD 患者带来福音。
参考文献
[1] Lee VM, Goedert M, Trojanowski JQ. Neurodegenerative tauopathies. Annu Rev Neurosci, 2001, 24: 1121 - 1159.
[2] Heneka MT, Carson MJ, El Khoury J, et al. Neuroinflammation in Alzheimer's disease. Lancet Neurol, 2015, 14(4): 388 - 405.
[3] Birks J. Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst Rev, 2006, (1): CD005593.
[4] Salloway S, Sperling RA, Aisen PS, et al. Lecanemab in early Alzheimer's disease. N Engl J Med, 2023, 389(7): 606 - 617.
[5] Zhang, Jifa et al. “Recent advances in Alzheimer's disease: Mechanisms, clinical trials and new drug development strategies.” Signal Transduct Target Ther, 2024 , 9(1):211.
[6] Cummings, Jeffrey et al. “Alzheimer's disease drug development pipeline: 2024.” Alzheimers Dement (N Y),2024, 10(2):e12465.

来源:CPHI制药在线


