您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-03-10 09:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
恒瑞旗下PD-1新增适应症获批。恒瑞旗下PD-1抑制剂注射用卡瑞利珠单抗增加适应症获国家药监局附条件批准,用于治疗既往接受过索拉非尼治疗/含奥沙利铂系统化疗的晚期肝细胞癌患者。该药此前已获批用于治疗复发难治性经典型霍奇金淋巴瘤。除卡瑞利珠单抗外,国内还有5款PD-1获批上市:帕博利珠单抗(可瑞达)、纳武利尤单抗(欧狄沃)、特瑞普利单抗(拓益)、信迪利单抗(达伯舒)和替雷利珠单抗(百泽安)。2019年抗PD-1抗体全球销售额约为188.09亿美元。
1.华海药业阿立哌唑片通过一致性评价。华海药业阿立哌唑片(5mg、10mg、15mg)获国家药监局核发的《药品注册批件》,该药视同通过一致性评价。阿立哌唑片主要用于治疗精神分裂症。该药原研药由Otsuka研发,于2002年获FDA批准上市,2004年获批进口中国。该品种获批的国内厂商主要有恩华药业、康弘药业等。2018年国内阿立哌唑片(包含片剂、口崩片)全国公立医疗机构销售额约人民币10.32亿元。
2.诺诚健华奥布替尼新适应症上市申请获受理。诺诚健华奥布替尼 (ICP-022) 用于治疗复发/难治性套细胞淋巴瘤(MCL) 患者的新适应症上市申请(NDA)获国家药监局受理。奥布替尼由诺诚健华自主研发,拟用于治疗多种B细胞恶性肿瘤及自身免疫性疾病,目前正在中美两国开展广泛的临床研究。此前,奥布替尼用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的NDA已于2019年11月获NMPA受理,并于2020年1月被纳入优先审评。
3.德琪医药ATG-008联合PD-1国内临床正式启动。德琪医药新一代mTORC1/2双靶点抑制剂ATG-008联合君实生物抗PD-1单抗特瑞普利单抗(拓益)治疗晚期实体瘤和肝细胞癌患者的临床试验已通过四川大学华西医院临床试验的伦理审批并正式启动。该试验为开放性、剂量递增和扩展研究,评估此联合疗法对晚期实体瘤和肝细胞癌患者的安全性、耐受性及药代动力学。ATG-008目前处于Ⅱ期临床阶段,德琪医药正在亚太地区开展多个ATG-008单用及联合其它药物的抗肿瘤临床试验。拓益是首个获批的国产抗PD-1单抗,用于治疗既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。
4.众生药业1类新药ZSP0678片获批临床。众生药业旗下众生睿创自主研发的1类新药ZSP0678片获国家药监局临床批件,拟开发适应症为原发性胆汁性胆管炎(PBC)。在临床前研究中,ZSP0678可剂量依赖性地显著降低PBC动物模型中升高的血清ALP和胆红素,剂量依赖地显著改善大鼠胆汁流速下降和胆汁淤积和肝功能损伤。ZSP0678片是众生睿创在肝病领域布局的第二个创新药,其用于治疗NASH的临床试验已获得NMPA的批准,在中国健康志愿者的I期临床试验已启动并完成首例志愿者入组和给药。
5.绿叶制药1类镇痛新药LY03014临床申请获受理。绿叶制药LPM3480392注射液(LY03014)的临床申请获国家药监局受理。LY03014是绿叶制药自主研发的镇痛类创新药,拟用于手术后中重度疼痛和癌性爆发痛的治疗。目前已完成的药效动力学和药代动力学研究显示:LY03014能显著抑制手术后疼痛和癌性疼痛,并减少呼吸抑制、便秘和阿片类药物耐受的发生。此外,已完成的毒理学研究和心血管系统长时程遥测试验显示,LY03014亦没有引起肝脏毒性和心脏QT间期的变化。
1.诺华/Recordati的11β-羟化酶抑制剂获FDA批准。诺华(Novartis)开发的11β-羟化酶抑制剂Isturisa(osilodrostat)获FDA批准,治疗成年库欣病(Cushing’s disease)患者。这些患者无法接受垂体手术,或在垂体手术之后仍患有这种疾病。去年7月,意大利Recordati公司从诺华收购了Isturisa的全球开发和推广权益。Isturisa是首个FDA批准的直接解决皮质醇生产过量的疗法。在一项临床研究中,接受Isturisa治疗24周之后,接近一半患者的皮质醇水平降低到正常范围内;此外,Isturisa的维持治疗与安慰剂相比,患者皮质醇水平维持在正常范围内的患者比率更高(86%vs30%)。
2.Urovant肾上腺素受体激动剂有望今年获批。Urovant Sciences公司在研小分子β-3肾上腺素受体激动剂vibegron的新药申请(NDA)获FDA受理,治疗膀胱过度活动症(OAB)患者的急性尿失禁(UUI),尿急和尿频症状。FDA预计将在12月26号前给予回复。一项Ⅲ期临床试验EMPOWUR结果显示,与安慰剂组相比,vibegron显示出统计学意义的显著有效性;在第12周时,vibegron与基线相比显著改善患者24小时内平均排尿和UUI事件次数。此外,该药物还达到其它七项预先设定的次要终点。
3.安进抗炎药Otezla第3个适应症在欧盟即将获批。欧洲药管局人用医药产品委员会推荐批准安进口服、选择性磷酸二酯酶4(PDE4)抑制剂Otezla(apremilast),用于适合系统疗法的成人患者,治疗与白塞病(BD)相关的口腔溃疡。Otezla也是唯一一种获得监管批准治疗与BD相关口腔溃疡的药物。自2014年首次上市以来,Otezla在全球范围内已获批三种适应症:中重度斑块型银屑病、活动性银屑病关节炎以及与BD相关的口腔溃疡。
4.小野制药Braftovi三药方案在日提交申请。小野制药(Ono Pharmaceutical)在日本提交MEK抑制剂Braftovi(binimetinib)与BRAF抑制剂Mektovi(encorafenib)联合抗人EGFR单抗Erbitux(cetuximab)治疗不可切除性晚期/复发性BRAF突变结直肠癌(CRC)的补充申请。在一项III期研究(BEACON CRC)中:与对照组相比,Braftovi三药方案显著延长患者总生存期(中位OS:9.0个月vs5.4个月),改善患者客观缓解率(26.1%vs1.9%);二药方案组(Braftovi+Erbitux)与对照组相比,其OS和ORR也具统计学意义的显著改善;在总的研究群体中,二药方案和三药方案的疗效相当,两种方案均没有表现出非预期的毒性。
5.罗氏暂停亨廷顿舞蹈病药物一项Ⅰ期临床。近日,罗氏(Roche)制药公司暂停了RNA药物tominersen(RG6042)用于治疗亨廷顿舞蹈症(HD)的一项Ⅰ期临床试验(BP40410)。该研究评估RG6042在脑脊液和血浆中的药代动力学和药效学以及鞘内给药对HD患者的安全性和耐受性。据称,此次试验暂停的原因是发生了两次鞘内导管相关感染的严重副作用事件(SAE)。但Clinicaltrials.gov网站显示,严重不良安全事件与试验药物本身无关。该药物的其他试验也均未受到影响,其中包括一项国际III期试验,该试验有望在2022年提供主要数据。
6.诺华与Orionis公司达成研发合作。Orionis Biosciences公司与诺华将利用Orionis专有的Allo-Glue小分子药物平台,联合开发包括蛋白质降解剂在内的创新小分子疗法。Orionis公司拥有A-Kine生物制品平台和Allo-Glue小分子药物平台。Allo-Glue分子是一类具有独特变构作用小分子,它可以进入以前认为无法接近的靶点。它的作用是改变细胞内蛋白的构象和与其它蛋白或小分子的结合能力,从而让这些蛋白能够被在研疗法靶向,抑制或改变其功能。
1.再生医学领域2019年年度报告发布。美国再生医学联盟(ARM)发布2019年年度报告。报告指出,再生医学领域在2019年获得了接近100亿美元的投资,目前有超过1000个临床试验正在进行中。该组织预计,今后两年,10多款基因和细胞疗法有望上市。根据ARM的统计,全球目前有超过987家再生医学公司。其中,美国最多(534家),亚洲(180家)位列欧洲之后。按照研发方向分类,专注于基因疗法的公司达到496家,开发细胞疗法的公司达到625家,有133家公司致力于进行组织工程和生物材料的开发。
2.阿达木单抗联合托珠单抗登记治疗临床。3月8日,中国临床试验注册中心增加1项随机平行对照新型冠状病毒相关研究登记《阿达木单抗联合托珠单抗在新型冠状病毒肺炎(COVID-19)重症和危重症患者的有效性及安全性研究》(注册号:hiCTR2000030580)。这也是托珠单抗参与的第4项相关研究、阿达木单抗参与的第2项相关研究。该项研究申请人所在单位为上海市第一人民医院;目的是评估在标准治疗基础上联合应用托珠单抗和阿达木单抗治疗重症和危重症新型冠状病毒肺炎的安全性及有效性。
3.武汉首批规模最大方舱医院休舱。3月7日下午,武汉首批最大的方舱医院——武汉客厅方舱医院患者清零,宣布休舱。休舱后,所有医护人员原地休息待命。据悉,武汉客厅方舱医院是武汉大学中南医院牵头筹建的全市首批规模最大的方舱医院,实际床位1461张。该方舱医院累计收治患者1760名,高峰时期在舱患者1434人,已治愈患者868人,实现了患者零死亡、医护人员零感染、安全生产零事故、进驻人员零投诉、治愈人员零复发“五个零”。患者满意度达99.44%。
4.新冠病毒演化出两个亚型。《国家科学评论》近日发表的论文《关于SARS-CoV-2的起源和持续进化》称,科研人员通过对目前为止最大规模的103个新冠病毒全基因组分子进化分析发现,病毒株已发生了149个突变点且多数是近期产生的。同时,新冠病毒已演化出L和S两个亚型。在103株病毒株中,有101个属于这两个亚型,其中L亚型占70%、S亚型占30%,为揭示新冠病毒的进化因素及其在人群中的传播模式提供了新的视角。
【上海医药】控股子公司上药中西右佐匹克隆片通过仿制药一致性评价,其主要用于治疗失眠,IQVIA数据库显示,右佐匹克隆片2019年医院采购金额为3.02亿元。
【威尔药业】2019年度公司实现营业收入8.8亿元(+9.9%),实现归母净利润1.3亿元(+15.48%)
【圣达生物】“圣达转债”已触发可转债的赎回条款,公司决定与3月10日提前赎回可转债,赎回款于3月11日发放,3月11日后“圣达转债”将停止交易和转股。
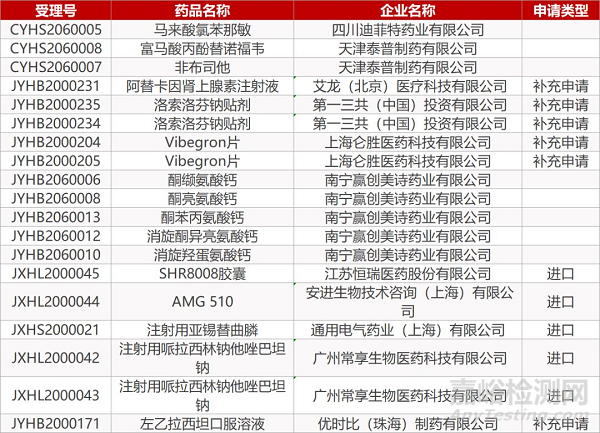
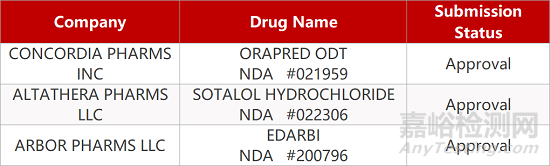
2. FDA最新获批情况(北美3月7日)
- The End -

来源:药研发


