您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-01-07 11:41
摘要: 本文列举了部分国内外监管机构发布的咀嚼片相关技术要求,并结合我国药品审评实际,分析咀嚼片注册申报资料中的常见问题。本文旨在探讨研发咀嚼片时应考虑的关键问题,以避免或减少在临床使用中的不良事件发生,提高患者的可接受性,保证药品的安全性、有效性和质量可控性。
咀嚼片与普通片剂和胶囊剂相比,服用方便,即使在缺水的条件下也可以按时用药,特别适用于吞咽困难或胃肠功能较差的患者,可减少药物对胃肠道的负担; 与口服混悬液相比,携带更方便,给药剂量更精准; 对于儿童患者,因咀嚼片有易于接受的颜色和形状,且通常具有良好的口感,使儿童不再惧怕服药,顺应性良好。
笔者列举了部分国内外监管机构发布的咀嚼片相关技术要求,并结合审评经验,对咀嚼片上市申请提交的申报资料中常见的问题进行探讨,以期为咀嚼片研发提供参考。
1、 国内外监管机构对咀嚼片研发的基本要求
FDA 于2018 年8 月正式发布了《咀嚼片的质量属性考虑》,为工业界研发咀嚼片时需要重点考虑的质量属性提供技术指导。为避免或减少咀嚼片药物在临床使用中的不良事件发生,提高患者的可接受性,国家药品监督管理局药品审评中心参考国内外监管机构发布的相关技术要求及国内外药典,并结合国内研发现状,于2023 年2 月正式发布了《咀嚼片( 化学药品) 质量属性研究技术指导原则( 试行) 》。本文列举了部分国内外监管机构发布的咀嚼片相关技术要求,具体见表1。

2、 咀嚼片注册申报的常见问题思考
在以往的咀嚼片药物开发中,在处方中通常不加崩解剂,并存在对咀嚼片的质量属性究和控制不够充分、对咀嚼片生物等效性试验服药方式缺乏研究等问题。以下就咀嚼片注册申报中常见问题进行分析,并提出建议。
2.1 处方中辅料选择依据不足
咀嚼片因其本身固有的特点及普通片剂不具备的优点,在临床用药上具有特殊的价值,尤其是在儿童用药方面[6],且由于咀嚼片在口腔中嚼碎停留,因此对口感和外观等要求相对更高[7],常在处方加入不同的香精、着色剂等,以改善口感和外观,部分咀嚼片辅料种类复杂,因此,结合患者用药人群特点、辅料功能和安全性、参比制剂辅料种类、产品口感等情况分析产品处方组成的合理性十分重要。申请人常在处方筛选方面存在缺陷,审评对于该类问题具有较高的发补率。
EMA 发布的儿童用药处方选择的相关指南中说明[8],鉴于许多着色剂与过敏反应和其他不良反应有关,除非必要,在儿科处方中应避免使用着色剂。国家药品监督管理局发布的《儿童用药( 化学药品) 药学开发指导原则( 试行) 》也提示了部分辅料在儿童人群中使用时的潜在风险。尽管一些申请人结合FDA IIG 数据库及原研产品特性说明了添加香精和着色剂的依据,但为证明产品中未引入额外的风险,建议申请人首先评估香精和色素使用的必要性。如确需使用,应进一步提供所用香精和色素用于儿童的系统性( 包括临床副作用) 安全评估资料。明确香精所有组成成分,提供其在已上市药品( 适应人群应包括儿童) 中使用的相应证明,并参考《儿童用药( 化学药品) 药学开发指导原则》和食品安全国家标准等相关要求,结合临床服用剂量和文献数据,对各辅料( 尤其是甜味剂、香精和色素) 的用量进行评估。重点关注天然着色剂可能引入过敏风险[9],同时,部分香精中可能含有醛类毒性物质,应对醛类等毒性物质在儿童用药中的安全性进行评估。
此外,FDA 于2018 年8 月发布的咀嚼片关键质量属性相关考虑指南中指出“咀嚼片会出现整片吞咽的情况,故要求较短时间内崩解以防止胃肠道阻塞”[1]。《咀嚼片( 化学药品) 质量属性研究技术指导原则( 试行) 》中指出,为促进药片的崩解和活性成分的溶出,建议在处方中适当加入适宜的崩解剂[3]。国内制药企业在咀嚼片处方开发过程中,容易忽略崩解时限的研究,缺少对处方中崩解剂使用的相关评估。例如某咀嚼片处方中未使用崩解剂,而在生产过程中仅对硬度进行控制,且在质量研究中未对崩解时限和溶出度研究。该控制策略容易导致产品崩解时限或溶出度不符合要求。建议参考FDA 指南及USP < 2 > Oral Drug Products—Product Quality Tests 要求[1, 10],对崩解时限进行研究,如有必要,应进一步对处方合理性进行评估。企业经补充研究,最终以崩解时限、口感、硬度和脆碎度为指标,在原申报处方基础上,添加一定比例的崩解剂,考察了新工艺验证样品在多种溶出介质中溶出行为,且在稳定性研究中对崩解时限、溶出度及硬度等进行了研究。将溶出度检查项订入标准,降低了制剂崩解相关质量风险,防止片剂在患者尚未咀嚼完全的情况下对胃肠道发生的阻塞[7]。
2.2 缺乏对患者可接受性的研究
某些咀嚼片药片较大、硬度较高,或使用了异形片形,进行患者可接受性研究对于保证咀嚼片临床用药安全具有重要影响。目前部分咀嚼片注册申请中,企业未能提供患者可接受性相关研究资料,或提供的验证资料不全面,如缺少对片形、大小、硬度范围及咀嚼难易程度的研究。
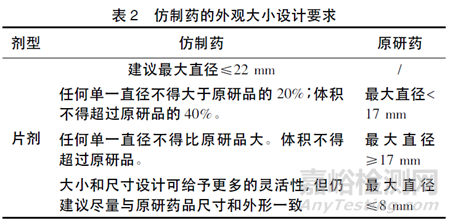
中国和EMA 发布的儿童、老年用药药学开发相关指南中均对片剂的大小、形状进行了关注。对于儿童用药,片剂的大小和形状会影响儿童能否顺利吞咽药片。由于目前各年龄段儿童对片剂的大小、形状和数量可接受性的相关研究数据有限,故药物开发时应就片剂大小和形状的选择提供适当的研究资料或临床证据。美国FDA 发布的《片剂、胶囊剂仿制药的大小、形状和其他物理属性的研究技术指导原则》[11]明确了片剂仿制药的具体要求。仿制药和原研药外观大小设计要求见表2。此外,FDA 发布的咀嚼片关键质量属性相关考虑指南鼓励申请人在产品研发期间累积和提交咀嚼难度指数的相关数据。
建议收集与患者可接受性和体内行为的相关信息,如易吞咽性、咀嚼难易程度等。结合收集的相关信息对所开发产品的患者可接受性和体内行为等进行全面分析和评估,必要时对处方工艺进行优化,以提高患者的可接受性。
2.3 关键质量属性研究不全面
以往的咀嚼片药物开发中,通常存在对咀嚼片的质量属性究不够充分,尤其是硬度、崩解时限及溶出度等关键质量属性,易导致其在临床使用中发生不良事件,如患者整片吞咽或不完全咀嚼导致的胃肠道梗阻、片剂硬度过大导致牙齿损伤以及引起其他食管刺激等,或者因整片吞咽或不完全咀嚼造成活性成分未在规定时间内充分的溶出。这也是目前咀嚼片注册申报中常见的问题。
例如某咀嚼片仿制药,处方组成及形状大小参照原研进行设计,质量控制方面仅对自制制剂的硬度、崩解时限和溶出度进行研究,但未订入标准,且工艺验证批硬度检测结果高于《咀嚼片( 化学药品)质量属性研究技术指导原则( 试行) 》及FDA 咀嚼片关键质量属性指南的常规要求( 12 kp) 。忽略对硬度范围关键质量属性的充分研究和控制最终可能会影响药品质量、安全性和有效性。硬度太大,则服用时不易嚼碎,影响口感; 硬度太小,则片剂在贮存、携带时易破碎[6]。建议提供制定硬度控制范围的依据,说明其控制范围的合理性,包括研究证明产品对于目标人群易于咀嚼的相关资料。
一般而言,建议将溶出度检查项列入咀嚼片终产品质量标准。但是对于质量标准中没有溶出度检查项且不适于或者有充分依据支持不必进行溶出度试验的咀嚼片,建议结合研究结果制定崩解时限的合理控制策略[3]。例如铝碳酸镁咀嚼片为无机盐类局部作用药物,国内外药典收载的本品标准中均无溶出度控制项。如未对该产品的崩解时限进行研究和控制,则可能带来肠梗阻等临床用药安全的风险,建议参考《咀嚼片( 化学药品) 质量属性研究技术指导原则》,将崩解时限订入质量标准,根据实测结果拟定合理限度。同时参考《关于胃肠道局部作用药物、电解质平衡用药仿制药质量和疗效一致性评价及特殊药品生物等效性试验申请有关事宜的意见( 征求意见稿) 》,重点关注其在人工胃液中的崩解时限。对自制品与参比制剂的崩解时限进行对比研究。
此 外,还应对影响体内行为的关键质量属性进行全面考察,以确保体内生物等效。国内制药企业在咀嚼片研发中,一般进行了溶出度研究,但容易忽略在模拟生理介质中考察溶出性能。建议参照Quality Attribute Considerations for Chewable Tablets Guidance for Industry 和《咀嚼片( 化学药品) 质量属性研究技术指导原则》,模拟空腹和餐后状态,选择合适的溶解介质( 如加酶胃液和肠液) 评价咀嚼片的溶出行为。如该产品适用于儿童,建议根据不同年龄段儿童生理特点,开展相关研究,选择符合目标患者人群特征的生理介质进行体外实验。
2.4 缺乏对部分咀嚼片服用方式与生物等效性关系的研究
与整片比,咀嚼后的片剂相当于进行了简单粉碎,由于其在体内的颗粒大小导致的比表面积差异,其溶出行为与未进行粉碎的片剂可能会有较大的区别[12-13]。因此, 生物等效性( bioequivalence,BE) 试验中咀嚼片服用方式不同( 充分咀嚼或整片吞服) 可能导致试验结果不同。国内外指导原则或指南均提及咀嚼片BE 试验给药方式的相关要求,具体见表3。

目前某些咀嚼片药品注册申请中,企业通常未能提供必要的服用方式与BE 相关性研究资料,尤其对于某些FDA 说明书中对服用方式有特殊说明的咀嚼片,建议企业在BE 试验中关注此类问题。例如拉替拉韦钾咀嚼片,FDA 公开审评信息对该产品在说明书中是否需明确规定咀嚼服用进行了讨论[17]。因此,建议对其在国外进行的药代动力学和关键临床试验中制剂服用方法进行汇总,对制剂咀嚼后服用与直接吞服可能引起的药代动力学差异进行评估,为说明书中的患者服用方法提供科学支持。
2.5 部分咀嚼片改良型新药缺乏临床优势依据
对于低龄儿童,咀嚼片的价值在很大程度上受患儿合作程度和咀嚼功能发育的限制。《儿童用药( 化学药品) 药学开发指导原则( 试行) 》中明确指出“对于片剂,应充分考虑到由于儿童不愿意或无法按照说明书服用口崩片和咀嚼片导致的窒息风险,此类制剂的最大片径和口感也需要特别关注”。国内制药企业在咀嚼片改良型新药立题时,常常不能充分评估咀嚼片改良型新药开发的临床优势以及研发依据。建议参考《儿童用药( 化学药品) 药学开发指导原则( 试行) 》、《儿童用化学药品改良型新药临床试验技术指导原则( 试行) 》等相关指南和技术要求,提供开展临床研究立题合理性的依据。
例如申请将普通片改为咀嚼片且适应证包含儿童用药的某改良新药,建议分析由普通片改良为咀嚼片时对于各种年龄段的患儿分别具有何种临床优势,同时分析不同年龄段儿童对咀嚼片整片大小和性状的接受性。并建议评估是否每个年龄段都可以做到充分咀嚼,若无法充分咀嚼是否对产品的吸收利用产生实质性的影响。
3、 结语
咀嚼片作为一种在口腔中咀嚼后吞服的片剂,临床服用方便,尤其适用于儿童、老人、吞咽困难或胃肠功能较差的患者,其药学研究应重点关注。但目前多数申请人提交的申报资料质量尚需改善。申请人应基于质量源于设计( QbD) 的理念进行咀嚼片开发,在研发过程中,需对咀嚼片的质量属性进行全面的分析和研究,结合研究结果制定合理的控制策略,以确保终产品始终满足预期的质量要求。
参考文献
[1] FDA.Quality Attribute Considerations for Chewable Tablets Guidance for industry ( draft guidance) [EB/OL].( 2016-06-16) [2024 - 04 - 11]. https: / /www. fda. gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm507 098.pdf.
[2] 姜成,赵斌锋.吡嘧司特钾咀嚼片的制备和质量考察[J].中国药剂学杂志( 网络版) ,2019,17( 6) : 243-250.
[3] 国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《咀嚼片( 化学药品) 质量属性研究技术指导原则( 试行)》的通告( 2023 年第7 号) [EB/OL].( 2023-02-15) [2024-04-13].https: / /www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20230215083957119.html.
[4] 国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《儿童用药口感设计与评价的技术指导原则( 试行)》的通告( 2022 年第37 号) [EB/OL].( 2022-11-04) [2024-04-13].https: / /www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20221104092809122.html.
[5] 孙艳喆,丛端端,耿莹,等.儿童用药口感研究设计与评价的审评考虑[J].药学学报,2023,58( 11) : 3160-3164.
[6] 施昕磊,黄绳武. 咀嚼片的研究进展[J]. 中国药业,2008( 14) : 17-19.
[7] 孙秉喆,邢嘉萌,严真,等.咀嚼片的研发要点及研究进展[J].中南药学,2022,20( 10) : 2373-2378.
[8] EMA.Reflection paper: Formulations of choice for the paediatric population[EB/OL].( 2006-07-28) [2024-04-15].http: / /www.ema.europa.eu/docs/en_GB/document _library/Scientific_guideline/2009/09/WC500003782.pdf.
[9] 国家药品监督管理局药品审评中心.国家药监局药审中心关于发布《儿童用药( 化学药品) 药学开发指导原则( 试行) 》的通告( 2020 年第67 号) [EB/OL].( 2020-12 - 31) [2024 - 04 - 15]. https: / /www. cde. org. cn /main /news /viewInfoCommon /95102a5facaf8fd4430d0916a24eab53.
[10] The United States Pharmacopeia.<2> Oral Drug Products—Product Quality Tests[EB/OL].( 2020-08-1) [2024-04-15]. https: / /online. uspnf. com/uspnf /document /1 _GUID -DA161518-EC27-4647-AACD-29D28F2A4E92_5_en-US.
[11] FDA.Guidance for Industry Size,Shape,and Other PhysicalAttributes of Generic Tablets and Capsules[EB/OL].( 2015-06) [2024 - 04 - 15]. https: / /www. fda. gov/media/87344/download.
[12] RENU J D,PAWAN J,BALVINDER S,et al. ChewableTablets: A Comprehensive Review[J].The Pharma Innovation Journal,2015,4( 5) : 100-105.
[13] 冯贻东,殷佳楠.对咀嚼片生物等效性给药方式的探讨[J].中国现代药物应用,2018,12( 13) : 219-221.
[14] EMA.Guideline on the Investigation of Bioequivalence[EB/OL].( 2010 - 01 - 29) [2024 - 04 - 15]. https: / /www. ema.europa. eu/en/investigation - bioequivalence - scientific -guideline.
[15] FDA.Bioequivalence Studies With Pharmacokinetic Endpoints for Drugs Submitted Under an ANDA Guidance for Industry( Draft) [EB/OL].( 2021-08-23) [2024-04-15].https: / /www.regulations.gov/document/FDA-2013-D-1464-0017.
[16] 国家食品药品监督管理总局.总局关于发布普通口服固体制剂参比制剂选择和确定等3 个技术指导原则的通告( 2016 年第61 号) [EB/OL]. ( 2016 - 03 - 18)[2024- 04 - 15]. https: / /www. nmpa. gov. cn /xxgk /ggtg /ypggtg /ypqtggtg /20160318210001725.html.
[17] FDA.Summary Review for ISENTRESS[EB/OL].( 2011-12-30) [2024 - 04 - 15]. https: / /www. accessdata. fda. gov/drugsatfda_docs/nda/2011/203045Orig1s000SumR.pdf.
内容来源:药学研究 2024年10月

来源:Internet


