您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-24 14:28
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.盈科生物丙泊酚即将获批上市。盈科生物4类仿制药「丙泊酚中/长链脂肪乳注射液」上市申请进入“在审批”状态,预计即将获批上市,成为该品种首家通过一致性评价的产品。丙泊酚中/长链脂肪乳注射液是临床常用的麻醉剂之一,原研是费森尤斯卡比。公开数据显示丙泊酚中/长链脂肪乳注射液在2019年中国公立医疗机构终端销售额达到19.5亿元,同比增长20%,其中原研仍占市场大头。
2.海思科培哚普利叔丁胺片即将获批。海思科培哚普利叔丁胺片4类仿制上市申请进入“在审批”阶段,有望近期获批上市,成为该品种首家通过一致性评价的产品。培哚普利叔丁胺片是一款非巯基长效ACEI抑制剂,用于治疗高血压与充血性心力衰竭。米内网数据显示,2019年中国公立医疗机构终端培哚普利叔丁胺片的销售额为7.6亿元,目前获得批文的企业有两家,暂无企业通过一致性评价。
3.康弘药业氢溴酸伏硫西汀片申报上市。康弘药业抗抑郁药氢溴酸伏硫西汀片的4类仿制上市申请获CDE受理。米内网数据显示,2019年中国公立医疗机构终端伏硫西汀片剂销售额3000余万元,同比增长超过700%,生产企业仅有灵北一家(商品名:心达悦)。在此之前,该产品扬子江以仿制3类、正大天晴和成都倍特药业以仿制4类提交上市申请,目前正处于在审评审批中。
4.康哲药业/太阳制药替拉珠单抗启动III期临床。康哲药业与太阳制药联合开发的IL-23单抗Tildrakizumab(替拉珠单抗)登记启动一项治疗中重度斑块状银屑病的III期临床。该项研究拟入组220例患者,评估Tildrakizumab与安慰剂相比治疗12周的有效性,主要研究者是中国人民解放军空军军医大学第一附属医院的王刚主任。替拉珠单抗最早由默沙东研制,太阳制药通过授权获得其全球独家权益。目前替拉珠单抗已在美国/欧洲/澳大利亚获批上市,商品名为Ilumya(欧洲为Ilumetri)。
5.和铂医药新一代CTLA-4抗体获批两项临床。和铂医药CTLA-4单抗HBM4003获国家药监局两项临床试验默示许可,拟针对黑色素瘤和其他实体瘤,开展HBM4003单药和与君实生物PD-1特瑞普利单抗联合用药的临床研究。在临床前研究中,HBM4003单药已表现出显著提高的抗肿瘤药效,在联合抗PD-1疗法用药时,也进一步显示出抗肿瘤的协同药效。HBM4003目前已在美国获批临床试验,并于2019年底在澳大利亚完成了Ⅰ期临床首例患者给药。
国际药讯
1.礼来Olumiant新适应症获欧盟CHMP推荐批准。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准礼来与Incyte联合开发的口服JAK抑制剂Olumiant(baricitinib),用于治疗适合系统治疗的中重度特应性皮炎(AD)成人患者。CHMP的积极意见,基于Olumiant的Ⅲ期临床BREEZE-AD研究项目数据,该项目包括2项单药研究(BREEZE-AD1和BREEZE-AD2)和2项联合治疗研究(BREEZE-AD4和BREEZE-AD7)。作为单药疗法以及联合标准护理局部皮质类固醇时,与安慰剂相比,Olumiant均显著改善了疾病严重程度、有更高比例的患者皮损完全清除。
2.Blueprint精准KIT抑制剂关键性临床结果积极。Blueprint Medicines公司KIT/PDGFRA激酶抑制剂Ayvakit(avapritinib)在治疗晚期全身性肥大细胞增多症的Ⅰ期临床EXPLORER和Ⅱ期临床PATHFINDER中获积极结果。在EXPLORER试验中,中位随访27.3个月时,Ayvakit的客观缓解率达到75%,其中36%的患者达到完全缓解伴部分血液学缓解(CR/CRh),中位缓解持续时间为38.3个月;在PATHFINDER试验中,中位随访10.4个月时,Ayvakit的ORR达到75%,19%的患者达到CR/CRh,中位DOR尚无法评估。该公司计划第四季度向FDA提交补充新药上市申请。
3.诺华Tafinlar+Mekinist黑色素瘤术后辅助治疗结果公布。诺华Ⅲ期COMBI-AD研究积极结果已发表于《新英格兰医学杂志》。高危III期BRAF阳性黑色素瘤患者手术切除黑色素瘤后,使用Tafinlar(dabrafenib)与Mekinist(trametinib)进行术后辅助治疗时,这一组合疗法与安慰剂相比,使患者在5年内存活且无复发的比例提高(52%vs36%),将患者复发或死亡风险降低49%,Tafinlar+Mekinist治疗组中位RFS尚未达到,安慰剂组中位RFS为16.6个月,两组5年无远处转移生存率(DMFS)为65%和54%。
4.BMS多发性骨髓瘤BCMA CAR-T获FDA优先审评资格。FDA受理了百时美施贵宝与蓝鸟生物联合开发的BCMA CAR-T细胞免疫疗法idecabtagene vicleucel(ide-cel)的上市申请,用于治疗至少接受过三种疗法(包括免疫调节剂、蛋白酶体抑制剂和抗CD38抗体)的复发/难治性多发性骨髓瘤(R/R MM)患者。FDA并授予其优先审评资格,PDUFA日期为2021年3月27日。今年5月,FDA曾拒绝受理ide-cel于3月提交的上市申请。此次是7月重新提交BLA后,获得FDA受理并获授予优先审评资格。
5.罗氏ipatasertib治疗前列腺癌结果积极。罗氏在ESMO2020年会上公布ipatasertib一线治疗转移性去势抵抗性前列腺癌III期临床的早期顶线结果,数据显示,在肿瘤中抑癌蛋白PTEN功能缺失的患者中,达到了放射学无进展生存期(rPFS)共同主要终点。在免疫组化分析确认为PTEN缺失的患者中,ipatasertib+Zytiga治疗的中位rPFS为18.5个月、Zytiga为16.5个月;在下一代测序确认为PTEN缺失的患者中, ipatasertib+Zytiga治疗的中位rPFS为19.1个月、Zytiga为14.2个月。
6.泰瑞沙辅助治疗NSCLC III期临床结果积极。阿斯利康在ESMO2020年会上公布第三代EGFR-TKI药物Tagrisso(泰瑞沙,奥希替尼)III期ADAURA研究探索性分析结果。在已接受治愈性完全肿瘤切除术的早期EGFRm突变的非小细胞肺癌(NSCLC)患者中,与安慰剂相比,泰瑞沙辅助治疗的患者出现复发事件或死亡的人数较少(11%vs46%);在癌症复发的患者中,泰瑞沙组患者发生转移性复发的比例更少(38%和61%);泰瑞沙将中枢神经系统(CNS)复发或死亡的风险降低了82%(p<0.0001);两组的中位CNS DFS均未达到。
医药热点
1.北京大学国际医院获DNV GL双项认证。9月22日,DNV GL集团向北京大学国际医院正式授牌,北京大学国际医院成为中国第一家同时获得DNV GL 国际医院管理认证和感染风险管理认证的医疗机构,也是中国第一家由DNV GL按照感染风险管理标准(CIP)认证的医疗机构。此次获得双认证,标志着医院的医疗质量和服务与国际标准接轨,将使北京大学国际医院成为众多社会办医机构在医院质量安全与管理方面的标杆和典范。
2.俄将于10月注册第二种新冠病毒疫苗。俄罗斯联邦消费者权益保护和公益监督局新闻处22日发布消息称,其下属的俄罗斯“矢量”病毒学与生物技术科研中心开发的新冠病毒疫苗将于10月15日之前完成注册。这是一种基于肽抗原的疫苗,俄卫生部已从9月18日开始审查疫苗的相关文件,这将是俄罗斯第二种获得注册的新冠病毒疫苗。据悉除了这两款疫苗外,俄罗斯还有20余种疫苗正在开发中。
3.GEN公布2020获NIH资助最多的50所机构。基因工程和生物技术新闻网站(GEN)发布《2020年获NIH资助最多的50所机构》榜单。该榜单以截止今年9月在NIH 2020财年获得资助的金额和项目总数作为排名依据。这50所机构获得的拨款奖励总额高达172亿美元、项目总数30710项。位列榜单前五的分别为约翰霍普金斯大学(722890568美元)、加州大学旧金山分校(636062320美元)、加州大学洛杉矶分校(629215516美元)、弗莱德哈钦森癌症研究中心(589904570美元)、密歇根大学安娜堡分校(579203245美元)。
股市资讯
【智飞生物】由公司全资子公司北京智飞绿竹生物制药有限公司研发的轮状病毒灭活疫苗获得国家药品监督管理局药物临床试验批准通知书(通知书编号:2020LP00507),同意本品进行临床试验,其临床试验申请于2020年6月24日获得受理。
【金河生物】公司新建年产52000吨兽药级高效金霉素1000吨盐酸金霉素原料药项目,预计总投资6.65亿元。
【华大基因】公司控股子公司华大因源医药科技有限公司制造的两项新冠病毒、甲流病毒及乙流病毒联合核酸检测试剂盒于近日完成欧盟CE认证。
审评动向
1. CDE最新受理情况(09月24日)
2. FDA最新获批情况(北美09月18日)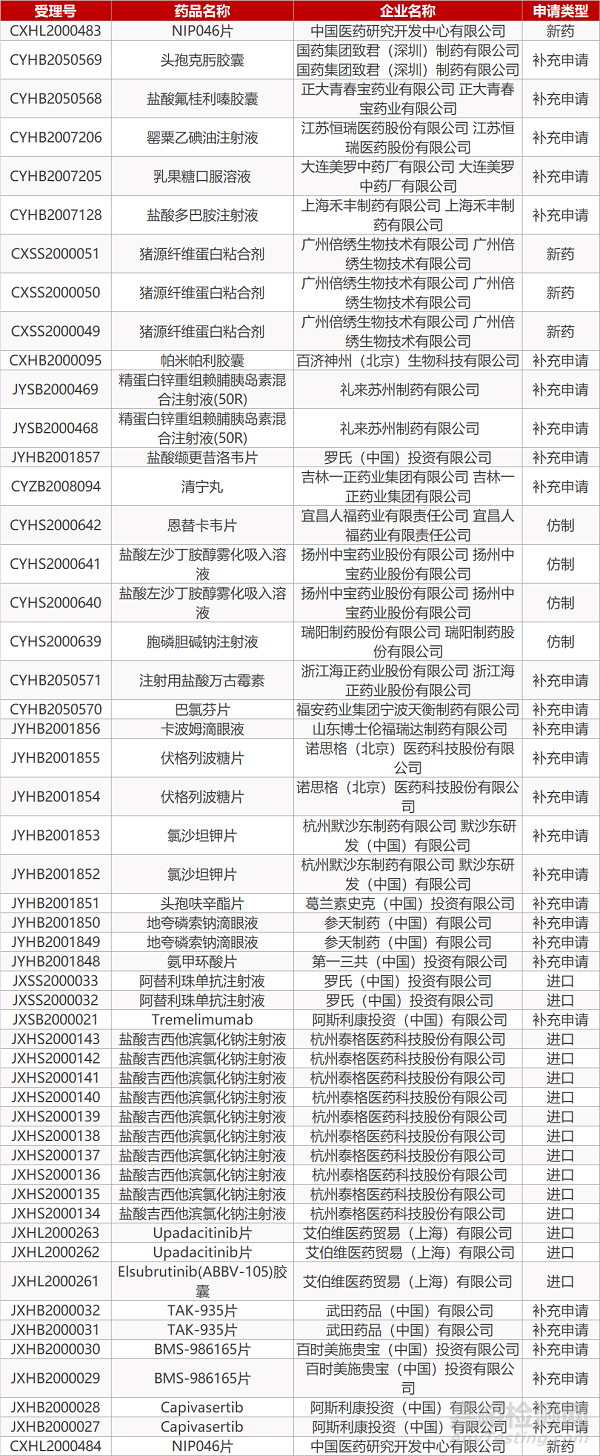
暂无
- The End -

来源:药研发


