您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-20 11:42
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:14条资讯,阅读时长约:3分钟 」
今日头条
北京生物新冠疫苗Ⅰ/Ⅱ期临床结果发表。《柳叶刀-传染病》最新发表了由北京生物制品研究所有限责任公司、中国疾控中心等多家机构联合开发的新冠灭活疫苗BBIBP-CorV的临床研发进展。Ⅰ/Ⅱ期试验中,BBIBP-CorV在所有18-80岁的健康受试者中都表现出了良好的安全性,并均诱导了免疫反应。在接种第28天时,两次接种4μg的三组疫苗受试者体内,疫苗引起的中和抗体滴度都显著高于8μg接种一次(14.7),其中0/21天4μg(282.7)和0/28天4μg(218.0)方案的抗体滴度比0/14天(169.5)更高。目前,BBIBP-CorV正在阿拉伯联合酋长国开展Ⅲ期试验。
国内药讯
1.恒瑞盐酸普拉克索缓释片获批上市。恒瑞医药盐酸普拉克索缓释片获国家药监局批准上市,并视同通过一致性评价。盐酸普拉克索缓释片是一种帕金森治疗药物,原研厂家为勃林格殷格翰,于1997年7月获FDA批准上市,2005年4月获批进入中国。国内目前获批的普拉克索剂型主要为片剂和缓释片。其中,缓释片已有京新药业率先获批,为该剂型首家通过一致性评价的厂家。
2.苑东生物格隆溴铵注射液即将获批上市。苑东生物格隆溴铵注射液3类仿制上市申请已进入“在审批”状态,有望近期获批上市。格隆溴铵为季铵类抗胆碱药物,具有抑制胃液分泌及调节胃肠蠕动作用,适用于胃及十二指肠溃疡、慢性胃炎、胃酸分泌过多等,静注或肌注可用于麻醉前给药。2020年10月10日,恒瑞医药宣布其格隆溴铵注射液获批上市,为该产品“首仿+首家过评”企业。
3.扬子江药业氟比洛芬酯申报上市。扬子江药业氟比洛芬酯注射液3类仿制上市申请获CDE受理。该产品目前仅有北京泰德制药(中国生物制药子公司)以及武汉大安制药获得批文,是第一批国家集采目录品种。米内网数据显示,在中国公立医疗机构终端化学药抗炎药和抗风湿药市场中,氟比洛芬是TOP3品种,2017、2018年销售额均破20亿元。
4.景峰医药兰索拉唑申报一致性评价。景峰医药子公司锦瑞制药提交的“注射用兰索拉唑”一致性评价补充申请获CDE受理。注射用兰索拉唑是一种质子泵抑制剂,原研厂家为武田制药,于1991年12月首次在欧洲上市,获批用于口服疗法不适用的伴有出血的胃溃疡、十二指肠溃疡、急性应激性溃疡、急性胃粘膜病变等疾病的治疗。目前注射用兰索拉唑原研药品尚未在国内上市。
国际药讯
1.罗氏/艾伯维Venclexta组合治疗AML在美获批。罗氏旗下基因泰克公司宣布,FDA全面批准Venclexta®(venetoclax)联合阿扎胞苷、或地西他滨、或低剂量阿糖胞苷,治疗75岁或以上新诊断或患有共病妨碍接受强化诱导化疗治疗的急性髓系白血病(AML)患者。Venclexta已于2018年11月获得FDA的加速批准,此次是FDA将Venclexta的加速批准转变为完全批准。在一项Ⅲ期临床VIALE-A中,Venclexta联合阿扎胞苷与阿扎胞苷相比显著降低了34%的患者死亡风险(平均OS:14.7月vs9.6个月;p<0.001)。
2.赛诺菲Dupixent获欧盟推荐扩大适用人群。赛诺菲与再生元联合开发的IL-4/IL-13靶向单抗Dupixent(dupilumab)获欧盟CHMP推荐批准扩大适用人群,用于治疗适合系统疗法的6-11岁中重度特应性皮炎(AD)儿童患者。今年6月,Dupixent获得FDA批准扩大适用人群,用于上述相同年龄段(6-11岁)中重度AD儿童患者。值得一提的是,Dupixent是第一个也是唯一一个在美国获批用于≥6岁、在欧盟获批用于≥12岁的不受控中重度AD患者的生物药。
3.Opdivo获欧盟CHMP推荐批准治疗食管癌。欧洲药品管理局人用医药产品委员会(CHMP)推荐批准百时美施贵宝PD-1疗法Opdivo(欧狄沃,nivolumab)一个新的适应症,用于治疗先前接受以氟嘧啶和铂为基础的联合化疗后病情进展的不可切除性、晚期、复发或转移性食管鳞状细胞癌成人患者。在一项III期ATTRACTION-3研究中,Opdivo与紫杉烷化疗相比显示出更优的总生存期(OS)结果(HR=0.77;95%CI:0.62-0.96;p=0.0189)。化疗组中位OS为8.4个月(95%CI:7.2-9.9),Opdivo组中位OS达到10.9个月(95%CI:9.2-13.3),无论PD-L1表达水平如何。
4.罗氏Evrysdi在日本申请上市。罗氏旗下中外制药在日本提交了SMN2剪接修饰剂risdiplam用于治疗脊髓性肌萎缩症(SMA)的新药申请。Evrysdi是首个获批用于SMA的口服疗法,已于8月获FDA批准,用于治疗2个月及以上儿童和成人SMA患者。在2项(FIREFISH和SUNFISH)研究中,Evrysdi显示在不同年龄和疾病严重程度(包括1型、2型、3型)SMA患者中使运动功能获得临床意义的改善。接受Evrysdi治疗的婴儿,能够在没有支撑的情况下坐立至少5秒钟。此外,与自然病史相比,Evrysdi还提高了12个月和23个月时无永久通气的生存率。
5.强生Stelara治疗克罗恩病获长期疗效数据。强生制药在UEG 2020年会上公布了抗炎药Stelara(喜达诺,ustekinumab)治疗中重度克罗恩病(CD)的Ⅲ期IM-UNITI开放标签扩展(LTE)研究的积极数据。在随机化分配接受SC Stelara Q8W并且在LTE研究中继续接受这一方案的患者中,维持长达5年的临床反应和临床缓解的患者比例分别为57%和55%,而且在处于临床缓解的患者中,93%没有使用类固醇;研究中,Q8W Stelara组与安慰剂组的事件发生率基本相当,未观察到新的安全信号。
6.Apexigen公司CD40单抗获FDA孤儿药称号。FDA授予Apexigen公司CD40靶向单克隆抗体APX005M孤儿药资格,用于治疗食道和胃食管连接癌(GEJ)及胰腺癌。在一项Ⅰb期临床试验(NCT02482168)中,30例实体瘤患者接受了该药物治疗,有24例可评估主要终点。58%的患者中观察到肿瘤缩小,33%的患者观察到稳定,仅4%的患者有进展。而且APX005M在食道癌,GEJ和胰腺癌患者中具有可耐受的安全性。
医药热点
1.日本发明通过呼吸检测新冠技术。据日媒报道,日本东北大学和岛津制作所联合开发出一种只需对人呼出的气体进行检测,即可判断是否感染新冠病毒的技术。据悉这是全球首个通过呼吸检测新冠的检测技术。该检测方式通过对人呼出气体里的病毒和蛋白质进行分析,来判断是否感染,接受检测的人只需在医院或者家中,对着专用的检测设备呼气约5分钟即可。这种检测方法的精度与核酸检测相当,大约1个小时就能出结果。
2.浙江启动新冠肺炎疫苗接种工作。新冠肺炎疫苗紧急接种工作在浙江省率先启动。根据嘉兴疾控中心发布的《新冠疫苗接种的有关说明》,新冠疫苗接种2剂次,间隔14-28天,疫苗价格为200元/支,2剂次共400元。嘉兴市目前用于紧急接种的新冠疫苗由省级部门统一向北京科兴中维生物技术有限公司征订,逐级分发至定点接种单位。该疫苗尚未正式注册上市,经依法批准用于紧急接种。
3.甘肃省将5种特殊疾病纳入医保报销范围。甘肃省医保局宣布将5种严重精神障碍类疾病纳入医保门诊慢特病补助管理范围。新增的5种严重精神障碍类疾病包括:分裂情感性障碍、偏执性精神病、双相(情感)障碍、癫痫所致精神障碍、精神发育迟滞伴发精神障碍。其中,分裂情感性障碍、偏执性精神病、双相(情感)障碍、癫痫所致精神障碍年度内最高支付限额为3500元,精神发育迟滞伴发精神障碍年度内最高支付限额为3000元,超过限额部分由个人自付。
股市资讯
【复星医药】公司控股子公司上海复宏汉霖生物制药有限公司的注射用曲妥珠单抗新增“60mg/瓶”规格获国家药品监督管理局药品注册补充申请审评受理。该新药为本集团自主研发的单克隆抗体生物类似药,主要用于HER2阳性的转移性乳腺癌、HER2阳性的早期乳腺癌及HER2阳性的转移性胃腺癌或胃食管交界处腺癌治疗等。2019年,曲妥珠单抗于中国境内的销售额约为45.77亿元。
【恒瑞医药】2020Q1-Q3实现营业收入194.13亿元(+14.57%),归母净利润42.59亿元(+14.02%),扣非归母净利润41.41亿元(+17.11%);2020Q3实现营业收入81.04亿元(+17.13%),归母净利润15.97亿元(+20.74%),扣非归母净利润15.79亿元(+26.58%)。
审评动向
1. CDE最新受理情况(10月19日)
2. FDA最新获批情况(北美10月16日)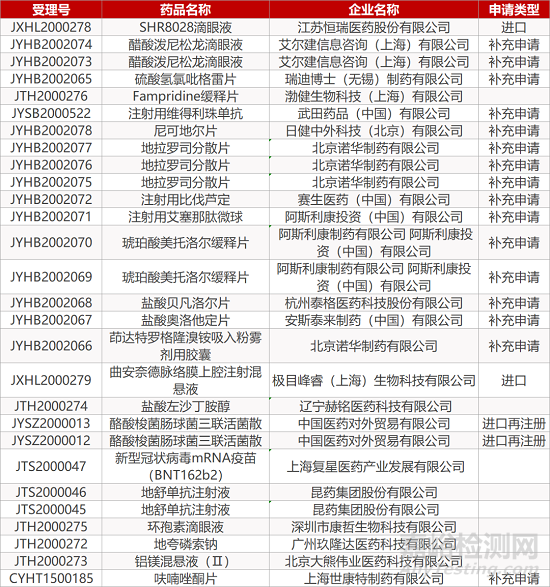
暂无
- The End -

来源:药研发


