您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-10-26 09:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.武田艾替班特拟纳入优先审评。武田醋酸艾替班特注射液上市申请获CDE纳入拟优先审评公示名单,适应症为「成人、青少年和≥2岁儿童的遗传性血管性水肿(HAE)急性发作」。艾替班特(Icatibant)是一款高选择性缓激肽B2受体拮抗剂,由武田旗下夏尔制药原研,是FDA批准的第3个遗传性血管水肿治疗药物。当前,国内原研和仿制药均未上市。圣诺生物2018年5月提交了3类仿制药上市申请,当前正处于第一轮补充资料任务中。
2.普锐特药业硫酸特布他林申报上市。普锐特药业4类仿制药硫酸特布他林雾化吸入用溶液上市申请获CDE受理。特布他林吸入剂可用于支气管哮喘,慢性支气管炎,阻塞性肺气肿或其他肺部疾患引起的支气管痉挛。米内网数据显示,在中国公立医疗机构终端特布他林吸入剂是个超10亿的品种,领军企业为阿斯利康。2020年4月,美大康华康药业硫酸特布他林雾化吸入用溶液6类仿制上市申请获批,该品种暂无企业过评。
3.恒瑞PD-1联合阿帕替尼III期临床获批。恒瑞医药PD-1卡瑞利珠单抗联合用药的临床试验申请获国家药监局批准,即将开展III期临床,评估卡瑞利珠单抗联合阿帕替尼用于肝细胞癌(HCC)根治性手术或消融后伴高复发风险人群的辅助治疗。根据Insight数据库,卡瑞利珠单抗当前已有四大适应症获批,分别为晚期/转移性肝细胞癌、非鳞状NSCLC、食管鳞癌、经典型霍奇金淋巴瘤,另有鼻咽癌适应症上市申请中。
4.博安生物地舒单抗注射液在欧洲获批临床。绿叶制药旗下博安生物的重组抗RANKL单抗注射液(地舒单抗注射液,LY06006/LY01011)已获得德国联邦卫生部疫苗和生物医学联邦研究所(Paul-Ehrlich-Institut)批准启动临床试验。LY06006是规格为60mg/ml的地舒单抗注射液,为Prolia®的生物类似药;LY01011是规格为120mg/1.7ml的地舒单抗注射液,为Xgeva®的生物类似药。据公开财务报告显示:2019年,Prolia®的全球销售额达到26.7亿美元,同比增长16.6%;Xgeva®的全球销售额达到19.4亿美元,同比增长8.3%。
5.达石药业NGF靶向抗体临床申请获受理。达石药业1类生物新药DS002注射液临床试验申请获CDE受理。DS002是一种NGF靶向重组单抗,拟开发作为无成瘾性镇痛药。DS002已在临床前研究中显示出良好的安全性,在多种动物痛觉模型中也有很好的镇痛效果。公开资料显示,在作用机理上,DS002的新作用机制与阿片类药物和包括非甾体类抗炎药(NSAIDs)在内的其它镇痛药完全不同,不会有成瘾性的风险。
6.欧康维视生物合作新药获批临床。欧康维视生物和Nicox公司联合申报的1类新药NCX470滴眼液获CDE临床试验默示许可,拟开发用于降低开角型青光眼或高眼压症患者的眼内压。NCX470是一种第二代一氧化氮供体型比马前列素类似物,已在Ⅱ期临床中表现出相对于拉坦前列素的统计学非劣效及优效,可进一步将眼内压从基线最多降低至1.4毫米汞柱。两家公司计划近期启动NCX470的两项Ⅲ期临床试验,并计划使用全球试验所得数据支持日后于中国提交新药申请。
国际药讯
1.阿斯利康,强生新冠疫苗Ⅲ期临床将恢复。阿斯利康制药与牛津大学联合开发的新冠病毒疫苗AZD1222获FDA批准在美国恢复Ⅲ期临床。FDA审查了全球性临床试验获得的所有安全性数据,认为继续进行临床试验是安全的。目前该疫苗的Ⅲ期临床已在英国、巴西、南非和日本重新开始。强生同日也宣布,将在美国重启检验其候选新冠疫苗的关键性Ⅲ期临床。这两款疫苗此前均因在Ⅲ期临床中一名参与者出现严重不良反应而导致临床试验暂停。
2.安进CD19/CD3双抗组合治疗Ph+ ALL结果积极。安进双特异性抗体Blinatumomab联合第二代TKI达沙替尼(dasatinib),在治疗费城染色体阳性的急性淋巴细胞白血病(Ph+ ALL)的Ⅱ期临床中获积极结果。患者接受dasatinib诱导治疗后,再接受blinatumomab的巩固治疗,作为一线治疗,在中位随访期达到18个月时,患者的总生存率和无疾病生存率高达95%和88%。详细结果发表于《新英格兰医学杂志》上。这一“无化疗”的组合疗法有望为治疗ALL开启一个新时代。
3.Jazz公布发作性睡病创新疗法XywavⅢ期结果。Jazz公司公布Xywav(钙、镁、钾和羟丁酸钠)口服溶液治疗发作性睡病的全球Ⅲ期研究结果,与安慰剂相比,Xywav使患者在每周猝倒发作次数和Epworth嗜睡量表(ESS)评分方面表现出显著改善,结果具有统计学差异(p<0.0001);Xywav治疗组患者每周猝倒发作中位数显著低于安慰剂组患者(p<0.0001);Xywav治疗组患者中位ESS评分显著低于安慰剂组(p<0.0001)。FDA已批准Xywav用于治疗7岁及以上发作性睡病患者猝倒或日间过度嗜睡。
4.诺华罕见病药物branaplam获FDA孤儿药称号。FDA授予诺华制药小分子RNA剪接调节剂Branaplam(LMI070)孤儿药称号,用于治疗亨廷顿氏病(HD)。Branaplam通过改变SMN2的剪接模式来增加运动神经元蛋白的功能存活量,目前正在研究用于治疗脊髓性肌萎缩症(SMA)。诺华表示,该药物每周给药一次用于治疗SMA,同样的给药方案也可能用于HD。该公司计划在2021年开始在HD患者中进行branaplam的IIb期临床试验。
5.罗氏合作开发口服抗COVID-19病毒疗法。罗氏与Atea Pharmaceuticals将联合开发、生产和推广Atea公司的在研RNA聚合酶小分子抑制剂AT-527。AT-527正在Ⅱ期临床中用于治疗需要住院治疗的中度COVID-19患者;并计划明年第一季度启动Ⅲ期临床评估AT-527在医院外环境中治疗COVID-19患者的潜力。根据协议,Atea公司将获得高达3.5亿美元的前期付款;双方将合作加速AT-527的临床开发和制造;如果AT-527用于治疗COVID-19获批上市,Atea将保留AT-527在美国的推广权,罗氏将获得在美国以外推广AT-527的独家权益。
医药热点
1.国家医保局针对人大免费医疗建议的回应。国家医保局通过官网公布了对于十三届全国人大三次会议第8753号建议的答复。对于其中涉及的“实施免费医疗”建议,国家医保局称,考虑到我国还将长期处于社会主义初级阶段,财政支撑能力还很有限,医保筹资水平还不高,基金支撑能力还不足,如果实行免费医疗,不仅会压缩基本医疗服务范围,降低待遇水平,还可能会引起不必要的医疗浪费,长久来看不利于医疗保障制度可持续发展,不利于保障人民群众健康。
2.长三角中医内分泌代谢病专科联盟成立。为响应国家长三角区域一体化的战略,促进医疗质量均质化建设,推动中医药、中西医结合防治糖尿病及其他内分泌代谢疾病的创新合作,近日,由上海中医药大学附属曙光医院、江苏省中医院、安徽省中医院、浙江省中医院联合牵头发起,康弘药业支持的“长三角中医内分泌代谢病专科联盟”在上海成立。据悉,上海中医药大学附属曙光医院陆灏教授被选为专科联盟专家委员会执行主席。
3.新疆喀什发现一例无症状感染者。新疆卫健委最新通报,2020年10月24日,喀什地区疏附县对“应检尽检”人员进行定期检测中,发现1例新冠肺炎无症状感染者。该例无症状感染者,女,17岁,喀什地区疏附县站敏乡二村村民。目前,对其密切接触人员已全部实行隔离医学观察,并开展核酸检测,正在对该例无症状感染者曾经活动场所进行全面排查,有关信息将及时向社会公布。
股市资讯
【恒瑞医药】甲磺酸阿帕替尼片及注射用卡瑞利珠单抗获得药物临床试验批准通知书,将于近期开展临床试验。
【上海医药】控股子公司山东信谊的盐酸胺碘酮片通过仿制药一致性评价。
【上海凯宝】近日收到了国家知识产权局颁发一种治疗肠易激综合症的药物组合物及其制备方法和用途、一种治疗肠易激综合征的药物组合物及其用途、一种中药组合物的检测方法的发明专利证书。
审评动向
1. CDE最新受理情况(10月25日)
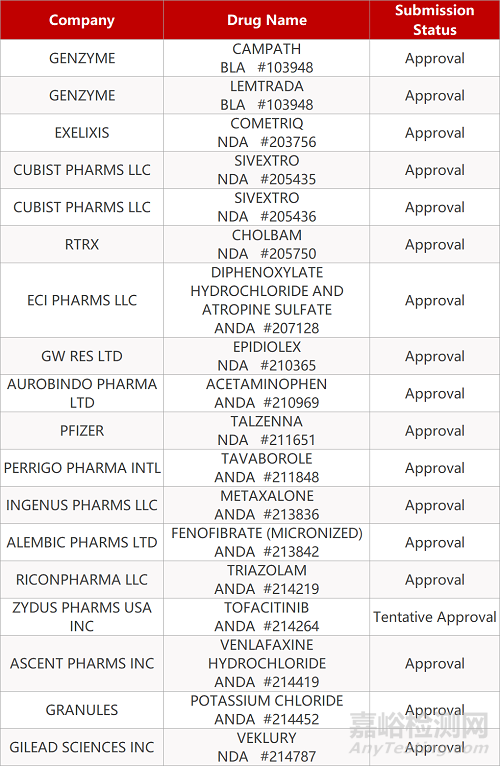
2. FDA最新获批情况(北美10月22日)
- The End -

来源:药研发


