您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-25 10:34
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:16条资讯,阅读时长约:3分钟 」
今日头条
《药品附条件批准上市技术指导原则(试行)》发布。11月19日,CDE发布《药品附条件批准上市技术指导原则(试行)》指出,药物临床试验期间,符合以下情形的药品,可以申请附条件批准:治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的。
国内药讯
1.信达阿达木单抗第4个适应症获批。信达生物阿达木单抗生物类似药苏立信获国家药监局批准,用于治疗多关节型幼年特发性关节炎。这是苏立信获批的第4个适应症,此前该产品已获批用于类风湿关节炎、强直性脊柱炎和银屑病。阿达木单抗原研是艾伯维研发的一款人源化抗TNF-α单抗,商品名为修美乐,已于2010年2月获批进口中国。全球范围内,阿达木单抗已获批用于治疗包括类风湿关节炎、强直性脊柱炎、银屑病、银屑病关节炎等十七种疾病。
2.润都制药单硝酸异山梨酯通过一致性评价。润都制药单硝酸异山梨酯缓释胶囊获国家药监局批准,成为该品种首个通过一致性评价的缓释胶囊剂型。单硝酸异山梨酯缓释剂型适用于冠心病的长期治疗,心绞痛的预防和心肌梗死后持续心绞痛的治疗等。目前国内申报一致性评价的剂型包括片剂(2家过评,3家在审评中)、缓释片剂(1家过评,2家在审评中)、缓释胶囊(1家过评,1家在审评中)。尚无注射剂一致性评价申报企业。
3.艾伯维维奈克拉片即将国内获批。艾伯维BCL-2抑制剂维奈克拉片的上市申请进入行政审批阶段,有望近期在国内获批,联合阿扎胞苷,或地西他滨,或低剂量阿糖胞苷用于治疗年龄75岁及以上或因合并症不适于接受强诱导化疗的新诊断的成人急性髓系白血病患者。venetoclax已在全球获批多个适应症,包括慢性淋巴细胞性白血病、小细胞淋巴瘤、急性髓性白血病,该产品全球年销售额也逐年递增,预计今年有望突破十亿美元。
4.圣和药业和乐布韦片拟纳入优先审评。圣和药业NS5B抑制剂和乐布韦片(SH229 )上市申请获CDE纳入拟优先审评公示名单,用于慢性丙型肝炎。在一项II期临床(CTR20182539)中,SH229联合达拉他韦治疗在1/2型 HCV(丙肝病毒)感染患者中的SVR12(12周病毒持续响应率)达到100%,在难治的6型HCV感染患者中的SVR12达到93.3%;所有受试患者耐受性良好,没有治疗相关SAE或因AE停药事件发生。
5.亚盛医药Bcl-2抑制剂APG-2575获两项临床许可。亚盛医药在研1类新药Bcl-2抑制剂APG-2575获CDE两项临床试验默示许可,将分别开展作为单药或联合依鲁替尼/利妥昔单抗治疗华氏巨球蛋白血症(WM)的Ib/ II期研究;以及作为单药或联合来那度胺/地塞米松治疗多发性骨髓瘤(MM)的Ib/ II期研究。APG-2575是首个在中国进入临床阶段的、本土研发的Bcl-2选择性抑制剂,其两个适应症(WM、慢性淋巴细胞白血病)已获FDA孤儿药资格认定。
6.默沙东拟收购昂科免疫。默沙东宣布将收购昂科免疫公司,并获得其临床阶段的可调节宿主对组织损伤的炎症反应的新型疗法CD24Fc。已完成的针对白血病患者接受造血干细胞移植后的急性移植物抗宿主病预防性治疗的Ⅱa期临床结果显示,CD24Fc使III-IV级移植物抗宿主病患者的180天无病生存率得到显著改善。该疗法还在治疗新冠疾病的Ⅲ期临床中取得积极顶线结果。这项交易的预付款为4.25亿美元,有望在今年年底前完成。
国际药讯
1.赛诺菲脑膜炎球菌病疫苗MenQuadfi®获欧盟批准。欧盟委员会(EC)批准赛诺菲巴斯德疫苗MenQuadfi®可针对12个月及以上的人群进行主动免疫接种,以预防由A、C、W和Y群脑膜炎奈瑟菌引起的侵袭性脑膜炎球菌病(IMD)。MenQuadfi此前已获FDA批准,用于预防2岁及2岁以上人群的IMD。此次EC批准是基于6300例12个月及以上健康受试者参与的七个关键Ⅱ期和Ⅲ期临床的汇总结果。目前,MenQuadfi还在Ⅲ期临床中评估用于保护6周龄以下婴儿的潜力。
2.阿斯利康Imfinzi新给药方案获FDA批准。FDA批准阿斯利康PD-L1度伐利尤单抗(Imfinzi)一种新的剂量选择:每4周一次固定剂量1500mg,用于先前已批准的非小细胞肺癌和前列腺癌适应症。这种新的4周给药方案将使医生可以选择将就诊次数减少一半,为患者提供更方便的治疗方案。此次批准基于多项Imfinzi临床试验的数据,包括ES-SCLC III期CASPIAN试验的结果,该试验在维持期间采用每4周一次固定剂量1500mg的给药方案。
3.诺华白血病靶向新药asciminib将公布关键临床数据。诺华将在ASH2020年会上公布其BCA-ABL酪氨酸激酶抑制剂asciminib与辉瑞Bosulif相比较三线或多线治疗慢性髓性白血病的ASCEMBL研究数据。ASH网站的摘要数据显示,asciminib治疗组分别有52%和28%为三线和四线患者,而Bosulif组分别为40%和38%;asciminib治疗组患者第24周的分子应答率为25.5%,而Bosulif组为13.2%,治疗差异的p值为0.029;asciminib的安全性较Bosulif更优,严重不良事件发生率更低。
4.Immunocore公司TCR疗法Ⅲ期临床结果积极。Immunocore公司创新T细胞受体(TCR)疗法tebentafusp治疗转移性葡萄膜黑色素瘤的Ⅲ期临床获积极中期结果。与研究人员选择的疗法(dacarbazine、ipilimumab或pembrolizumab)相比,tebentafusp显著提升患者总生存率(OS)。尽管目前数据尚未完全成熟,但tebentafusp组目前的一年生存率为73%,优于其他疗法组的58%。最终数据将在科学会议和同行评议期刊上公布。据悉,这是TCR疗法首个积极的Ⅲ期结果。
5.HLA-DR靶向ADC药物获FDA孤儿药资格。FDA授予Immunomedics公司(已被吉利德收购)创新抗体偶联药物(ADC)IMMU-140孤儿药资格,用于治疗急性髓系白血病(AML)。IMMU-140是一款将靶向HLA-DR的IgG4单克隆抗体与细胞毒素SN-38偶联起来的创新ADC。HLA-DR在血液癌症细胞中过度表达,是血液癌症的一个潜在的治疗靶点。在临床前研究中,IMMU-140已在多种血液癌症和恶性黑色素瘤模型中表现出活性。
6.安进终止心衰新药合作项目。安进终止与Cytokinetics公司心力衰竭药物的相关合作,将两款药物(omecamtiv mecarbil和AMG594)退还给Cytokinetics。终止合作是基于omecamtiv mecarbil用于治疗有症状的、射血分数≤35%的慢性心衰患者的Ⅲ期GALACTIC-HF研究结果不及预期。与安慰剂联合标准护理相比,omecamtiv mecarbil联合标准护理将心血管死亡或心衰事件的主要复合终点的风险在统计学上显著降低(HR=0.92;95%CI:0.86,0.99;p=0.025),达主要终点;但该药物并没有达到试验的次要终点,在心血管死亡时间方面没有观察到统计学意义上的降低。
医药热点
1.上海通报:感染源初步锁定。11月23日,上海市召开疫情防控新闻发布会,上海市疾控中心副主任孙晓冬表示,11月9日和10日确诊病例王某、兰某感染来源为曾于10月30日共同暴露的北美返沪航空集装器。根据流行病学调查,排除“人传人”导致感染可能性。经基因测序,2例病例基因高度同源,与北美流行株高度相似。
2.医药招采信用评级开始执行。11月20日,《医药价格和招采信用评级的裁量基准(2020版)》和《医药价格和招采信用评价的操作规范(2020版)》发布。根据这两份文件,“医药购销中,给予各级各类医疗机构、集采机构及其工作人员回扣或其他不正当利益”“因自身或相关企业实施垄断协议、滥用市场支配地位等被依法处罚,不主动纠正涉案产品的不公平高价”“以低于成本的报价竞标,以欺诈、串通投标、滥用市场支配地位等方式竞标,扰乱集中采购秩序”等行为被纳入《医药价格和招采失信事项目录清单》。
3.多部门将联合惩戒执业药师“挂证”。近日,国家药监局发布《关于规范药品零售企业配备使用执业药师的通知》指出,对查实的“挂证”执业药师,将录入全国执业药师注册管理信息系统,撤销其注册证书并予以曝光,还要将“挂证”执业药师纳入信用管理“黑名单”,实施多部门联合惩戒。
股市资讯
【海利生物】公司发明的“一种RHDV的亚单位疫苗” 获得发明专利,其是一种制备类兔出血症病毒(VLP颗粒)的方法,用该类病毒颗粒制备的亚单位疫苗,可有效控制、预防兔出血症病即兔瘟的流行。
【恒瑞医药】公司及子公司上海恒瑞医药有限公司、苏州盛迪亚生物医药有限公司的苹果酸法米替尼胶囊和注射用卡瑞利珠单抗被纳入拟突破性治疗品种,拟定适应症为联合治疗经过一线级以上治疗失败的复发转移性宫颈癌。
【白云山】公司使用原募投项目“大南药”生产基地一期建设项目之何济公异地改造项目募集资金及利息约38,428.87万元及信息化平台建设项目(本公司部分)募集资金及利息约10,472.50万元,共计约48,901.37万元,通过全资子公司化学药科技公司,向募投项目实施主体、全资孙公司化学制药(珠海)公司增资,用于化学制药(珠海)公司建设项目。
审评动向
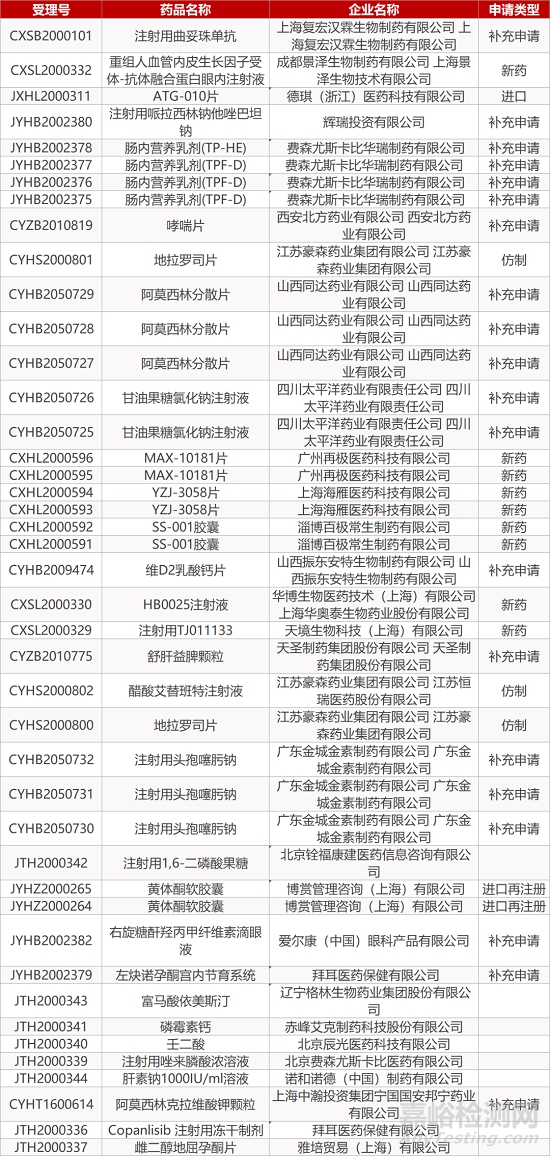
1. CDE最新受理情况(11月24日)
- The End -

来源:药研发


