您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-07 09:03
溶出是指药物活性成分从片剂和胶囊剂等普通制剂在特定条件下溶出的速率和程度,对于缓释制剂、控释制剂和肠溶制剂等,该过程也称为释放。
口服给药后,药物必须从制剂中溶出/释放出来,才可以被机体吸收并发挥作用,结合药物的生物药剂学(biopharmaceuticalclassificationsystem,BCS)分类,体外溶出实验通常被认为可预测药物的体内行为和生物利用度情况。
在药物制剂研发阶段,通过溶出测试评估制剂稳定性;监控处方和工艺参数等关键因素变化对终产品的影响;药物批准上市后,溶出检查则可以保障生产过程可控和药物产品质量可靠。
在药物的开发周期内,随着体内和体外研究经验和数据的积累,溶出方法将不断地被重新评估和完善,并在实现合理的简化后,用于终产品的日常质量控制。
溶出检查的最终目的是反映和控制药物制剂的体内溶出/释放行为。因此,无论在药物产品的开发阶段还是常规的质量控制阶段,均应使溶出方法具有一定的体内外相关性。
然而当前有部分溶出方法并未充分考虑IVIVC,使其仅仅成为药物体外的一种质量控制手段,不能真实反映药物体内释放情况。
对于某些特殊剂型(缓释制剂等)或特殊药物(治疗窗较为狭窄),其释药特性与其有效性和安全性密切相关,体外释放检查必须准确反映和控制药物体内释放情况,对于该类药物,建立具有体内外相关性的溶出检查方法和溶出度标准意义重大。
建立一种溶出度实验方法,需要考虑多方面因素。首先,应集中评估药物的物理化学性质及制剂学特征,以选择恰当的溶出介质和溶出装置;其次,通过体外不同溶出方法的摸索和对比,确定合适的溶出条件,使其不仅能够一定程度上反映药物的体内溶出环境及溶出行为,还能区分不同质量属性的药物;最后,需对所建立的溶出方法实施验证,确保其准确可靠,并具有一定的耐用性。
建立溶出方法前,应对药物活性成分的物理化学性质进行研究和考察,包括其同质多晶型、粒子大小和分布等,了解药物的滤膜滤过性及在不同介质和pH条件下的溶解度和稳定性,并结合药物的制剂学特征,合理地选择溶出装置、溶出介质及用量等。
溶出样品的过滤处理,对于取得准确的实验结果至关重要。过滤的目的是将未溶解的药物或辅料从溶液中去除,防止未溶出的药物颗粒继续溶解导致实验偏差。
过滤性考察应重点研究不同材质和规格的过滤材料对药物的吸附性、滤过性及样品的前处理方法等,以确定合适的过滤条件。
不同溶出介质的pH、缓冲体系、表面活性剂(针对水难溶性药物的制剂)对原料药的溶解度和稳定性往往有不同的影响。
溶解性是通过测试药物在不同溶出介质中的饱和溶解度得出的。通常情况下,不用有机溶剂作为溶出介质,但对于某些特殊药物,在合理论证后可以考虑使用。
Vignaduzzo等开发芬苯达唑−吡喹酮复方胶囊的溶出度实验方法,分别考量芬苯达唑和吡喹酮在水、二甲基甲酰胺、甲醇和乙醇等溶剂中的溶解情况,发现两药在水中的溶解性均很差,加入十二烷基硫酸钠(SLS)不能得到明显改善,最终选择了水−醇混合液作为溶出介质。
稳定性也应重点考察,deSouzaAnselmo等分别选用Tween-80和SLS两种表面活性剂对难溶性药物叶黄素片进行溶出研究,相比Tween-80,SLS明显影响叶黄素的稳定性。
推测原因,SLS是阴离子表面活性剂,其所携带的电荷可以促进叶黄素分子的氧化,从而加速其降解。
溶出介质对药物的溶出行为有重要的影响,溶出方法建立中应重点关注溶出介质的选择。介质的成分和体积是依据药物的溶解度和稳定性实验、药物制剂的制剂学特征和预期的体内溶出环境而确定的。
常用的溶出介质见表1,一般采用pH1.2~6.8的水性介质,特殊情况下,可采用高pH(一般不超过pH8.0)的溶出介质。

建立溶出方法,要求实现药物溶出的漏槽条件,所谓漏槽条件是指溶出介质用量至少达到使制剂中原料药饱和溶解所需介质体积的3倍,一般为500、900或1000mL。
对于某些水难溶性药物,需要较大用量的表面活性剂或较大体积的溶出介质以实现漏槽条件,而这样往往会失去溶出方法的生物相关性。
这种情况下,在合理论证后使用非漏槽条件也是可行的。一般不用纯水作溶出介质,因为其pH值和表面张力较难控制。
胶囊剂在贮存过程中,囊壳明胶可能发生交联形成膜壳,必要时需向介质中加入胃蛋白酶或胰酶,便于药物溶出。
近年来,一些生物相关介质越来越多地应用到药物的溶出研究中,如人工胃液和人工肠液等(表2、3)。
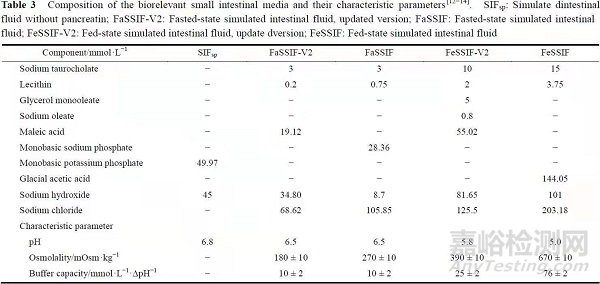
不同类型人工胃液或人工肠液的组成和配制方法各不相同,其可以分别模拟空腹和进食状态下胃/肠液的组成、渗透压和生理pH,如空腹和进食两种状态下的胃液,pH存在显著的差异。
将该类介质用于药物溶出研究,可以考察不同饮食状态对于药物溶出行为的影响,更好地反映体内的实际生理条件。
虽然漏槽条件对于药物的溶出有重要的意义,但当前采用非漏槽条件的生物相关介质进行溶出研究正逐渐成为趋势。
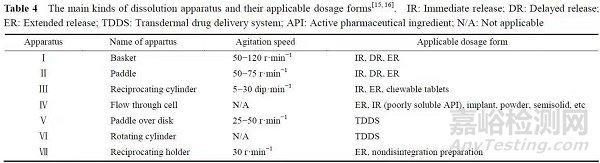
溶出仪器主要是依据药物制剂本身的因素和体外溶出特性选择的,通常应选用药典收载的溶出装置。
对于固体制剂,中国药典(ChP)收载了转篮法、桨法、小杯法、桨碟法和转筒法共5种溶出方法,其中篮法和桨法的装置简单、标准化程度高,适用于大部分口服制剂;小杯法可视为桨法,适用于低剂量规格的固体制剂。
美国药典(USP)则收载了篮法、桨法、往复筒法、流通池法、桨碟法、转筒法和往复架法共7种溶出方法。
优先选用篮法和桨法,对于这两种方法不适用的药物制剂可采用往复筒法或流通池法等。往复筒法除了用于常规制剂外,还用于咀嚼片和非崩解剂等。
流通池法的应用优势在于缓控释制剂和活性成分溶出度有限的速释制剂等,值得注意的是,该方法所提供的液流冲击作用比较微弱,使其不适用于黏度大、对机械搅拌作用依赖性高的药物制剂。
常见溶出装置的主要特征及适用剂型见表4。
从生理学角度考虑,口服药物进入体内后的崩解/溶出及转运和吸收是一个动态连续、同时进行的过程,若能通过体外溶出检查同时模拟这些生理过程,便可实现药物溶出/跨膜吸收的同步评价。
常规的溶出模式在药物溶出/吸收的同步评价方面尚存在很多不足,需要进行适当的改进以实现更好的生物相关性,如基于桨法或篮法的体外双相溶出模式理论上可以同步模拟药物溶出/转运过程;或选用能全面模拟胃肠道生理结构和功能的新型仿生溶出系统,以更好地预测药物的体内溶出/吸收情况。但选用该类装置时,应对其合理性做出说明。
建立溶出方法,首先应确定药物的BCS分类,特别是对于速释制剂。根据药物的剂型特征,判断药物进入体内后将遇到的生理环境,尽可能使体外的溶出条件模拟体内的生理介质、生理pH和胃肠蠕动等,确立体内相关性最大的溶出条件。
溶出方法建立的过程包括对溶出介质的选择和搅拌速率的摸索、采样时间点/采样方式的设置和对溶出过程的评估等关键环节。
某些药物制剂对于介质中溶解的气体较为敏感,当有气泡出现在药物制剂或篮网上时,可能妨碍药物溶出。
此外,气泡可以导致药物颗粒紧贴在仪器壁上,减少药物与介质的接触面积,可能降低溶出速率;黏附在药物制剂上的气泡则会增加药物的浮力,可能增加溶出速率。低溶解度的药物对于气泡的干扰尤为敏感。因此,必要时需对介质进行脱气处理。
常用的脱气方法包括加热、过滤或真空抽滤等。当确定了合适的脱气方法,应将其记录为溶出方法的一部分。
某些药物制剂(尤其是胶囊剂)在溶出介质中容易上浮,这种问题在建立溶出方法时应予以考虑。
沉降装置被用来调节药物所受的浮力,通常用在桨法中防止药物上浮,保证其正常溶出。同样,沉降装置也用于易黏在溶出杯上的片剂等。常见的沉降装置见图1。

体外机械搅拌可以有效地模拟体内胃肠道生理蠕动和食物对药物的摩擦作用等。对于多数药物制剂,溶出实验应在温和的条件下进行(表4),以保证溶出方法的区分性。
对于篮法和桨法,搅拌太慢或太快(25~150r·min-1之外的搅拌速度)均会导致混合作用不一致。
如果要建立IVIVC,通过减少或增加仪器转速可以使溶出数据更好地反映药物的体内行为也是可行的,但要控制方法的变异性。往复筒法的搅拌作用受筒体往复运动和样品在介质中相对运动的影响。
流通池法中,溶出介质的不同流动模式对药物的溶出会有不同的影响,常用流速为4、8和16mL·min-1,其搅拌作用不仅与介质流速有关,而且受流通池规格的影响。
对于速释制剂,溶出实验的时间通常为30~60min。建立的溶出方法,应以10min或更短的间隔取样,设置足够多的取样时间点来充分描述溶出曲线的上升和平台阶段。缓控释制剂的情况类似于速释制剂,但释放时间更长(8~24h)。
迟释制剂通常需要相继在酸性介质(0.1mol·L-1HCl)和pH6.8缓冲介质中进行释放研究。酸性阶段的时间通常是2h,在缓冲介质中释放时间类似于速释制剂。
总之,溶出实验应至少持续至药物溶出/释放基本完全。
通过绘图、拍摄照片或视频来记录药物制剂的崩解和溶出过程是非常必要的,对于崩解和溶出行为的宏观观察可以指示药品处方或制剂工艺的变化,这对于建立溶出方法和处方工艺的优化非常重要。
建立溶出方法,对于取样方式应作规定。当搅拌速度非常慢时,如篮法50r·min-1,应在溶出仪器中同一位置采样,避免可能存在的浓度梯度带来实验误差,取样位置不能过分靠近转轴或容器壁。
由于溶出模式不同,溶出数据分为累积溶出数据和微分溶出数据,其中累积溶出数据较为常见,而对于流通池法开放式工作模式得到的微分溶出数据,可用积分法将其转换为累积数据形式,以便溶出曲线的统计学比较。
溶出样品处理和检测是溶出实验中的一个重要环节。过滤或离心操作可除去样品中未溶出的制剂微粒,避免其继续溶出造成实验偏差。
一般不采用离心法,因为离心处理可能使样品的上清液形成浓度梯度或pH梯度,导致检测不准;离心作用提供的能量也会使未溶出的药物颗粒溶解量急剧增加。样品检测作为溶出实验的一部分,需对其摸索和优化以提高准确性。
Vignaduzzo等采用响应面分析法(RSM)摸索了流速、pH和有机相比例等色谱条件对高效液相(HPLC)法分离效能的影响,确定了阿苯达唑−吡喹酮复方片溶出样品HPLC检测的最佳条件。
目前溶出实验的多个环节都可以实现自动化,包括自动定时取样、样品处理、样品检测、设备清洗及溶出数据计算等。
溶出仪器和实验过程的自动化虽然减少了实验者的工作量,但仪器性能可靠性的问题可能会引入新误差。
建立一种溶出方法后需要进行验证,主要包括对样品分析方法和溶出过程的验证,为其用于日常检验提供依据。
样品分析方法的验证包括方法的专属性、线性和范围、精密度、准确性/回收率、耐用性以及溶出样本和标准样品的稳定性考察等;溶出过程的验证包括对其区分性和耐用性的评价。
具有良好区分性的溶出方法对药物关键质量属性的变化有较高的敏感度。一种可行的方法是通过制备两批体外溶出行为不同的制剂样品,进行体内测试,如果两批样品显示了不同的体内行为,则可认为体外溶出方法得到了验证。
对溶出方法耐用性的评价,应考察溶出介质的组成(缓冲盐或表面活性剂、pH、溶解气含量)及体积、搅拌速率、采样时间和温度等因素发生微小变化对溶出结果的干扰,该验证是采用质量良好的制剂产品(具有良好的含量均匀性和较为一致的溶出特性)完成。
Abualhasan等建立了芦丁片体外溶出方法,通过变更溶出介质的pH、样品检测的紫外吸收波长和不同实验人员3种因素,应用方差分析法进行统计学检验,验证了新溶出方法的耐用性。
该验证有助于确定溶出方法中上述可变因素必须控制的范围。
根据关键生物利用度实验和/或生物等效性实验批次样品的溶出数据及药品研发过程中的经验,兼顾统计学处理的需要,制定溶出/释放度检査方法和标准,溶出度标准需具有一定体内相关性。
药物溶出实验结果被认为是与关键临床试验批次质量特性的“链接”。
当处方和生产过程发生某些变化而显著影响药物的溶出行为,最终影响体内生物利用度时,溶出实验和其验收标准要能反映和区分这些变化。
响应面分析法是确定关键生产变量(CMV)与体外溶出曲线及体内生物利用度数据效应面之间相关关系的研究方法。
关键生产变量包括可显著影响制剂体外溶出的制剂处方、工艺、设备、原材料和方法等。
通过调节不同的关键生产变量,制备两个或多个样品制剂,并研究其体外溶出特征;再对具有最快和最慢溶出度特征的样品与标准制剂进行体内对比实验;最后测定和分析这些受试样品的生物利用度及体内外关系,该方法可有效地研究CMV对药品性能的影响,为溶出度限度的合理制定提供依据。
虽然美国食品药品监督管理局推荐用响应面分析法制定溶出度标准,但此方法的相关研究和应用却很少。
对于速释制剂,通过对完整溶出曲线的分析,合理简化后确立溶出实验时间和验收标准。速释制剂的溶出度检测包括单点检测和多点检测。
单点检测:可作为常规的质量控制方法,适用于快速溶出的高溶解性药物制剂,如ChP关于对乙酰氨基酚片的溶出检查,仅设置了30min一个取样点,要求溶出量为80%;两点或多点检测:这种方法能反映制剂的溶出特征,可作为某些水溶性差且溶出缓慢的药物制剂常规质量控制方法,如USP关于卡马西平片的溶出方法,分别设置15和60min两个取样点,要求15min溶出量在45%~75%、60min时不低于75%。
肠溶包衣剂是最常见的迟释制剂。前文已提及迟释制剂的溶出实验分为两阶段,每一阶段都有相应的验收标准,通常至少应设置两个取样点。
酸性介质中的检测为确保肠溶涂层的正常性能,以保证在酸性环境下,药物不发生明显的释放;在pH6.8缓冲介质中释放标准类似于速释制剂。
缓释制剂的溶出度测试通常持续时间更长,一般至少应设置3个取样时间点。
申报药物审批时可能需要更多的取样点。较早的时间点被用来检测和防止药物的剂量倾泻效应;中间时间点包含一个溶出率范围(溶出窗),用来表征制剂的体外释药特性;最后的时间点用来显示药物基本释放完全。
而控释制剂除以上3点外,还应至少增加2个取样点,其释放度范围应小于缓释制剂,即对其释药特性有更严格的要求。
对于该类制剂,若能获取人体生物利用度数据,可通过构建IVIVC来确立溶出度标准。
根据药物的治疗窗、溶解性及渗透性的不同,对体外溶出度实验条件的要求也不同。
对于某些特殊药品,需要在多种条件下进行溶出考察,以有效地表征和控制药物溶出/释放特性,确保药品质量和用药安全性。
例如,USP关于盐酸羟考酮缓释片列出了两种溶出测试,各有3~4个取样时间点。
还有很多关于速释制剂和迟释制剂多重溶出检测的例子,例如,USP关于左甲状腺素钠片和泮托拉唑钠迟释片提出了4种溶出测试。

来源:Internet


