您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-06 18:12
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
广州溯原vMIP抗新冠新机制上NATURE子刊。广州溯原研发的创新药重组病毒趋化因子炎性蛋白(vMIP‑Ⅱ)去年疫情期间在武汉开展治疗新冠的疗效良好,其抗新冠的机制为促进CD8+ T细胞去磷酸化,通过PI3K-AKT-mTOR信号通路,从而诱导新冠患者的效应CD8+ T细胞转化为中枢记忆型TCM,相关研究成果日前发表在Nature子刊《Signal Transduction & Targeted Therapy》上。vMIP‑Ⅱ是由卡波氏肉瘤疱疹病毒K4基因编码的一种人趋化因子小分子蛋白,具有结合多种人趋化因子受体亚族的能力,被认为是广谱的趋化因子受体抑制剂。据广州溯原首席科学家、暨南大学教授孙晗笑介绍,vMIP‑Ⅱ在作用机理上可以有效对抗各种病毒感染,针对前期抗新冠的良好疗效,现准备申请抗新冠的Ⅱ期临床许可。
国内药讯
1.武田戈谢病新药在华获批。国家药监局批准武田旗下Shire公司酶替代疗法注射用维拉西酶α(velaglucerase alfa)上市,用于治疗I型戈谢病患者。注射用维拉西酶α是一种水解性溶酶体特异性葡萄糖脑苷脂酶,该药设计用以替代1型戈谢氏病患者缺乏的葡萄糖脑苷酶,拥有与体内自然产生的酶相同的氨基酸序列。2010年2月,注射用维拉西酶α在美国获批上市,用于儿童和成人的1型戈谢病的长期酶替代治疗,商品名为Vpriv。
2.杨森CD38单抗在华获批新适应症。NMPA批准杨森CD38单抗达雷妥尤单抗注射液(兆珂,daratumumab)的新适应症,与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药,治疗经治、多发性骨髓瘤(MM)患者。临床研究表明,与来那度胺和地塞米松相比,daratumumab联合来那度胺和地塞米松使经治MM患者的疾病进展或死亡的风险降低63%。与硼替佐米和地塞米松相比,daratumumab联合疗法使经治患者的疾病进展或死亡的风险降低61%。
3.绿叶复方脂质体创新药上I期临床。绿叶制药抗肿瘤创新制剂盐酸伊立替康氟脲苷脂质体注射液(LY01616)治疗晚期消化道肿瘤的I /II期临床首例患者入组。该项临床旨在评估LY01616的安全性、耐受性、PK特征和初步临床疗效。LY01616能够以特定协同比例将伊立替康和氟脲苷共同包载于复方脂质体中。临床前各项试验证实:LY01616给药后,伊立替康和氟脲苷两种药物将在体内长时间维持稳定的比例,发挥协同抗肿瘤作用,大幅缩短静脉滴注时间并提高临床给药便利性。
4.百济神州PARP抑制剂即将在华获批。百济神州PARP1/2抑制剂帕米帕利上市申请审评状态已变更“在审批”,有望近期获NMPA批准上市,用于BRCA突变、既往接受过两线或两线以上化疗的晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。根据Insight数据库,全球目前共有5款PARP 抑制剂获批,其中3款已在国内获批上市,分别是阿斯利康的奥拉帕利、恒瑞的氟唑帕利、再鼎的尼拉帕利。
5.恒瑞PD-1单抗获FDA肝细胞癌孤儿药资格。FDA授予恒瑞PD-1单抗卡瑞利珠单抗孤儿药资格,用于肝细胞癌适应症。此次孤儿药资格认定,是基于恒瑞目前正在美国开展的一项卡瑞利珠单抗联合甲磺酸阿帕替尼一线治疗晚期肝细胞癌的国际III期临床。该研究目前已完成全球入组,将在美国、欧洲、韩国和中国等13个国家和地区同步开展。在中国,卡瑞利珠单抗已获批霍奇金淋巴瘤、晚期肝细胞癌等5个适应症。
6.沃森生物引进siRNA抗流感创新药。圣诺生物与沃森生物签订一项合作协议,共同开发一款拟用于抗流感病毒的多肽纳米包载的双靶点siRNA创新药STP702。根据协议,沃森生物将获得STP702在大中华区(包括中国大陆、台湾、香港和澳门地区)的开发、注册、生产和商业化的独家权益;圣诺生物将获得约4150万元人民币首付款,里程碑潜在付款及未来的产品销售分成。
国际药讯
1.莫德纳新冠疫苗进WHO紧急使用清单。世卫组织30日宣布将美国莫德纳新冠疫苗列入紧急使用清单。莫德纳新冠疫苗是一款信使核糖核酸疫苗,也是美国最先开展临床试验的新冠疫苗。2020年12月,FDA批准该疫苗的紧急使用授权申请;2021年1月,欧洲药品管理局批准其在欧盟范围内上市。该疫苗也是第五种获得世卫组织紧急使用认证的新冠疫苗。
2.阿斯利康达格列净获FDA批准治疗慢性肾病。FDA批准阿斯利康SGLT2抑制剂达格列净扩展适应症,用于治疗慢性肾病(CKD)成人患者,缓解肾功能下降,以及降低肾衰竭、心血管死亡和因心力衰竭住院的风险。这也是达格列净在获批治疗2型糖尿病和心力衰竭之后,斩获的又一项重要适应症。在一项Ⅲ期临床DAPA-CKD中,与安慰剂相比,达格列净在标准治疗基础上,可使CKD患者的复合终点风险降低39%;使全因死亡风险显著降低31%。
3.CF三联疗法KAFTRIO获欧盟扩展标签。欧盟委员会批准Vertex制药三联疗法KAFTRIO® (ivacaftor/tezacaftor/elexacaftor)标签扩展,联合ivacaftor用于治疗年龄≥12岁的囊性纤维化(CF)患者(CFTR基因至少携带一个F508del突变)。CF是由CFTR基因某些突变导致的CFTR蛋白缺陷/缺失引起的。KAFTRIO旨在增加细胞表面F508del CFTR蛋白的数量和功能。去年8月,这一组合已获欧盟批准用于治疗年龄≥12岁的CF患者(这些患者携带一个F508del突变和一个最小功能突变或携带2个F508del突变)。
4.FDA专家组建议撤销K药和O药两项加速批准。FDA咨询委员会在重新审查默沙东Keytruda、百时美施贵宝Opdivo和罗氏Tecentriq的六项加速批准后,建议保留四项适应症批准:Keytruda用于二线治疗肝细胞癌和一线治疗泌尿系癌,Tecentriq用于一线治疗三阴性乳腺癌和一线治疗泌尿系上皮癌;建议撤销两项适应症批准:Keytruda三线胃癌适应症(6:2的票数建议撤销),以及Opdivo二线肝细胞癌适应症(5:4的票数建议撤销)。
5.百时美施贵宝PD-1获FDA优先审评。FDA受理百时美施贵宝PD-1抑制剂Opdivo的补充上市申请,作为辅助疗法,治疗接受根治性膀胱切除术的高复发风险肌层浸润性尿路上皮癌患者。FDA同时授予其优先审评资格,预计9月3日之前做出回复。在一项Ⅲ期临床CheckMate-274中,与对照组相比,Opdivo显著提高了患者的中位无病生存期(DFS)(21.0个月vs10.9个月)。
6.Galera胰腺癌联合疗法临床结果积极。Galera Therapeutics高选择性SODs类小分子药物GC4419在治疗局部晚期胰腺癌的Ⅰ/Ⅱ期临床中获积极结果。与立体定向放射治疗(SBRT)相比,GC4419与SBRT联用将患者中位总生存期(OS)提高接近1倍(20.9个月vs10.9个月);两组获得部分缓解的患者比例分别为29%和11%;局部肿瘤控制,发生癌症转移所需时间和无进展生存期等其它指标也得到改善。
7.Acceleron因未及时发布试验数据被FDA警告。FDA向Acceleron Pharma发出警告通知,指控该公司未在ClinicalTrials.gov网站上及时发布ALK1受体Fc融合蛋白dalantercept与axitinib联合用药的研究数据。在这项Ⅱ期临床DART中,与安慰剂联合axitinib的治疗方案相比,这一联合用药方案未能显著延长晚期肾细胞癌患者的中位无进展生存期(PFS),未能降低疾病进展或死亡的患者比例,未到达主要终点指标。FDA警告称,如果Acceleron未能在30天内在网站上发布试验结果,将对其处以10,000美元的罚款或起诉。
医药热点
1.上海成立免疫治疗创新研究院。上海市免疫治疗创新研究院日前在上海交通大学医学院附属仁济医院揭牌成立。该研究院将依托上海交通大学医学院及其附属仁济医院,积极探索体制机制创新,将深度融入张江、临港国家实验室整体发展布局,努力建设成为具有全球影响力的免疫创新策源地、免疫学领域的高端和关键人才的引育基地、国际一流的免疫学基础创新到产业应用的转化基地。首任院长由中科院院士董晨担任。
2.上海临床研究中心成立。上海临床研究中心日前在位于张江科学城的上海科技大学揭牌成立。该研究中心是上海市卫健委下属机构,由上海科技大学建设和管理,将以上海科技大学临床研究与转化医学协同创新平台为依托,布局与三甲医院的协同研究。初期将聚焦肿瘤性疾病、神经系统疾病、泛血管疾病、呼吸疾病、风湿及肌肉骨骼疾病、感官系统疾病等研究。
3.国家卫健委: 骨科医疗中心设置标准出炉。为了进一步推动骨科优质医疗资源扩容和区域均衡布局,提升骨科医疗服务保障能力,国家卫生健康委发布《国家骨科医学中心设置标准》和《国家骨科区域医疗中心设置标准》。标准中,除了对于骨科医学中心的硬件要求之外,更是对所需的医疗设备标准进行了公布。
审评动向
1. CDE新药受理情况(04月28日)
申请临床:
山东新时代的重组抗CD20人鼠嵌合单克隆抗体注射液和重组人源化抗PD-1单克隆抗体注射液、百济神州的BGB-11417薄膜包衣片(4个规格)、微芯生物的西奥罗尼胶囊(2个规格)、上海奕拓的ET0038片(2个规格)、信达生物的IBI360、葛兰素史克的GSK3196165 注射液(2个规格)、赛生医药的RRx-001注射液。
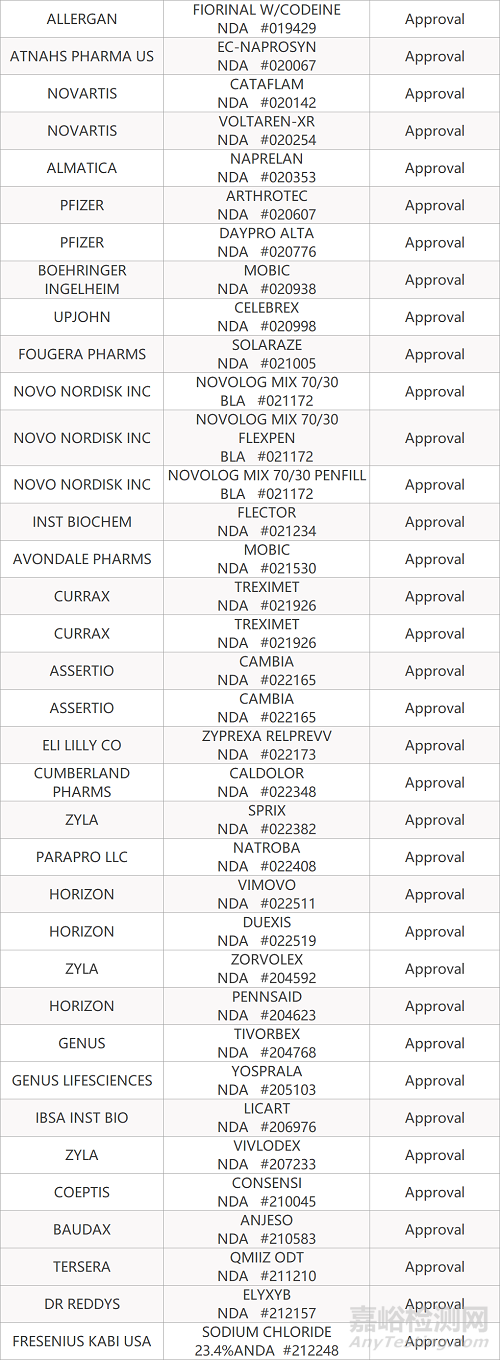
2. FDA新药获批情况(北美05月03日)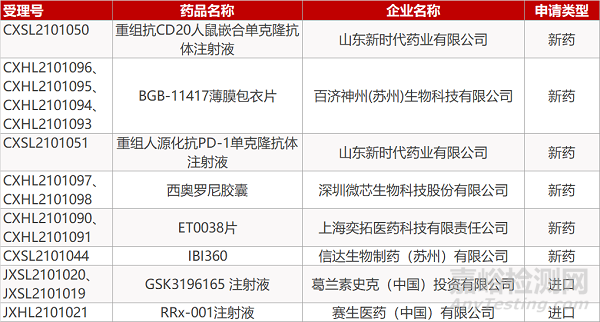


来源:药研发


