您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-22 10:04
近年来,质谱成像技术因其能够直观、快速、简便受到了代谢组学的青睐。然而,由于无法做到前端分离导致技术本身具有一定的局限性。将离子淌度与成像技术相结合,可以完美的解决上述问题,今天咱们就聊一聊DESI-IMS与MALDI-IMS有哪些区别?
如今LC-MS代表了靶向和非靶向代谢组学方法的基础,该方法可检测和阐明天然产物研究存在的低丰度代谢物。但是,MS没有提供有关生物样品中代谢物的时空分布信息。IMS(imaging mass spectrometry,成像质谱)通过将定性和定量分子信息与时空信息相结合,对传统的代谢组学和化学分析进行了补充,能够将特定分子映射到原始样品的2D或3D坐标上。IMS类型的“空间代谢组学”作为基因组学,转录组学和经典代谢组学研究的一种强大而互补的方法出现。
首先,让我们先来了解一下常用的质谱成像技术及其特点:
MALDI成像特点:
高成像分辨率;
需要样品前处理,基质的限制;
DESI成像特点:
适度的分辨率;
几乎无需样品前处理;
当成像技术遇到IMS离子淌度技术之后又会有怎样的化学反应呢?
IMS从本质上来讲,是根据分子的大小、形状和电荷等因素进行快速分离。
它可以快速区分结构类似物、同分异构体,还能消除化学噪音。
“分离”功能使得IMS可以快速简化谱图进行数据分析。
它还有助于识别实验中产生的多电荷物质,从而发掘出更多的信息。
IMS可基于漂移时间分离母体分子,因此有助于区分碎片离子。
可测得CCS值,有利于未知化合物的定性。
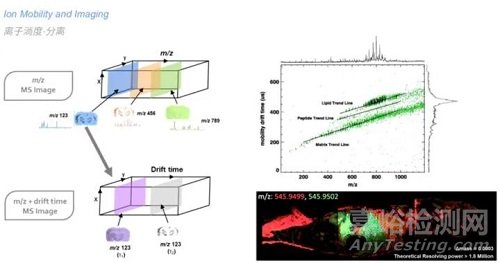
突破质谱分辨率限制,实现另一维度的分离。
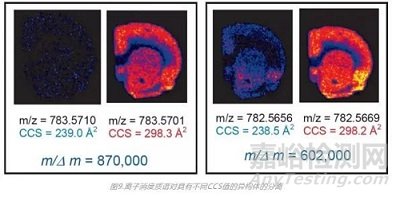
成像技术如MALDI和DESI得到的质谱图本身是很复杂的,要将MS成像结果与色谱图匹配上可谓难上加难。IMS弥补了这一技术空白,它能够在不改变解吸/电离步骤的前提下提供额外的分离维度,而且时间刻度与成像实验相同。获得除了分子质量、形状和电荷态之外,还有关样品中分子空间分布的关键信息。如下图,对于m/z相差小于4 ppm的化合物,质谱分辨率需达到870,000才能得到较好的分离。由于这些异构体离子对具有不同CCS值,即形状结构具有差异,因此通过离子淌度质谱即可对这些化合物进行有效分离。
DESI-IMS原理
综述总结了当前先进的IMS方法,重点是解吸电喷雾电离DESI-IMS。DESI-IMS利用电喷雾电离的原始原理,在环境条件下,将溶剂滴光栅化并直接在样品表面上解吸,可以进行快速且破坏性小的化学筛选,并能够以µm尺度的分辨率准确观察组织中的分子, 并且数据集可以提供每个检测到的分析物的图片。DESI-IMS分析不需要复杂的样品制备。由于其简便的工作流程和多功能性,DESI-IMS已成功应用于许多不同的研究领域,例如临床分析,癌症研究,环境科学,微生物学,化学生态学和药物发现。
在DESI中,高速电离的溶剂液滴直接从样品表面解吸感兴趣的分析物,在样品表面将化合物溶解在薄膜中。为了实现化学解吸,在高压下通过发射器毛细管对溶剂进行电喷雾,产生带电的“主要”液滴,将其雾化,然后导向样品。通过这种方式,位于样品表面的代谢物被解吸成气态的“次级”液滴,从而将分子离子输送到MS入口,在此处测量m/z值(图1)。根据目标代谢物的极性,可以使用来自DESI来源的不同喷雾溶剂进行成像。对于极性和非极性化合物的分析,通常使用标准溶剂(例如MeOH或ACN),通常添加2%至5%的H2O,但根据具体需要和应用,使用不同类型的溶剂组成。
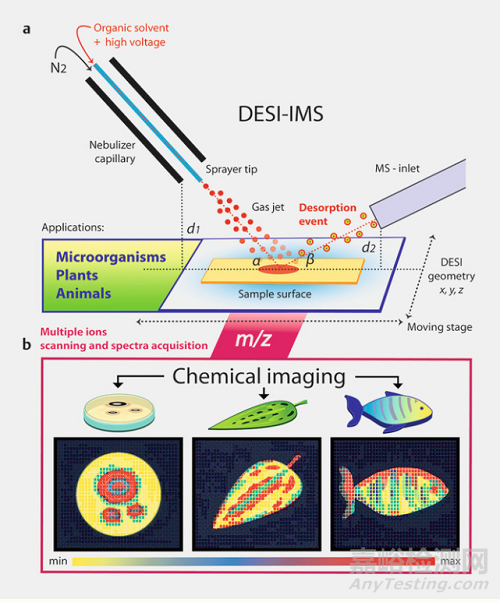
图1 DESI-IMS在大生物中的应用
MALDI-IMS原理
相比之下,典型的MALDI-IMS(基质辅助激光解吸电离质谱成像技术)实验中,样品被吸光基质涂覆或共结晶,并被来自UV或IR激光的脉冲照射。基质吸收辐射,将能量转移到样品中并帮助电离。MALDI有几个瓶颈,包括低质量范围(<300 m/z)的高化学噪声,这些化学噪声源于基质成分,可能抑制关键的小分子离子,并且要求将样品安装在导电表面上。激光解吸/电离过程还会在MALDI-IMS过程中破坏样品。由于MALDI-IMS是在真空下进行的,因此通常必须在分析之前将样品冷冻干燥,从而使这些技术与活组织不兼容。同时运用MALDI所检测的代谢物类型为:蛋白、多肽和脂质。DESI与MALDI的不同之处在于,DESI被认为是一种最小破坏性的电离方法。DESI-IMS分析所需的相对有限的样品前处理与活组织的最小破坏性采样相结合,使DESI-IMS能够填补其他IMS方法无法接近的领域。这些特性使DESI-IMS成为有效的研究工具。
对生物医学研究的贡献
通过将IMS应用于MS成像分析,可以减少背景噪音,从而大幅提升鉴定结果的可信度。随着IMS-MS技术的发展,如今我们无需标记即可直接检测组织中的蛋白质,使得该技术在蛋白质成像研究中表现出明显的优势。例如,研究发现IMS-MS技术能够为我们分析组织样品胰蛋白酶酶解物中的蛋白质提供极大助益。
IMS-MS在生物医学领域也有许多令人振奋的应用。它能有效鉴定复杂样品中的化学物质,因此成为了制药研究中极具价值的研究工具。例如,它被用于绘制给药前和给药后,小鼠组织中长春碱(一种抗癌药物)的分布图。IMS-MS还能对生物标志物(例如胰腺癌相关生物标志物)进行原位鉴定,从而协助肿瘤分类,帮助医疗专业人员全面表征癌症。如果配合SYNAPT XS,IMS-MS的分辨率将变得更高,可进一步推进生物医学研究。
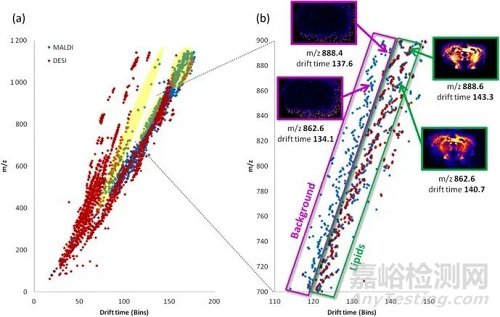
成像技术的应用
IMS-MS可以鉴定生物组织中的代谢物,帮助研究人员信心十足地确认代谢过程中涉及的分子变化。例如,使用IMS-MS可以分析可卡因对大鼠神经元代谢组的作用,帮助我们深入了解滥用药物引起的代谢变化。
此外,由于脂质易电离且通常会产生各种同分异构体,IMS-MS在脂质结构分析中非常有用。这对制药行业而言意义重大,因为脂质可能与多种疾病有关,而且具有治疗潜力的化合物可能隐藏在人体的脂肪组织中。目前已有研究人员使用IMS-MS成功鉴定了大鼠脑中的磷脂和磷脂形成的非共价复合物,为未来的研究奠定了基础。
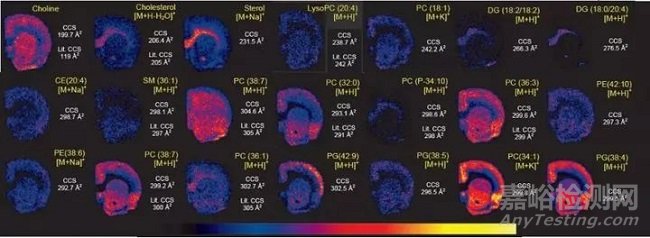
另外,近年来,Image-IMS-MS技术在中药和天然产物中marker的寻找和分布研究、小分子代谢物在体内的分布研究等领域的应用,也是引起前沿科学家的关注。
MALDI/DESI—IMS双成像技术结合离子淌度
基质辅助激光解吸电离(MALDI)和电喷雾解吸电离(DESI)这两种成像技术具有不同的特点和性能,如果将两者相结合,再加上离子淌度技术,可分析更多类的物质,满足更多样的研究需求。
MALDI-MS虽然需要对样品进行前处理,但能够精准分析大分子和小分子。另一方面,DESI-MS的空间分辨虽然不如MALDI,但它的样品前处理简单,并且可以产生丰富的数据而不损坏样品。发表于Method上的一篇文章论述了MALDI与DESI两种技术结合淌度质谱在小鼠大脑切片中的应用,配合使用,可检测得到更丰富的信号。
最近有研究表明,适当增加某些样品前处理步骤可使DESI产生大量的多电荷离子,从而对样品中的完整蛋白质进行成像。由于直接使用组织切片得到的质谱图较为复杂,如果不使用离子淌度技术进一步分离,是观察不到这些多电荷蛋白质离子的。
看完文章是不是对于AFADESI-MSI、DESI-MSI、MALDI-MSI的区别还不是非常明晰?来看看这张图表吧
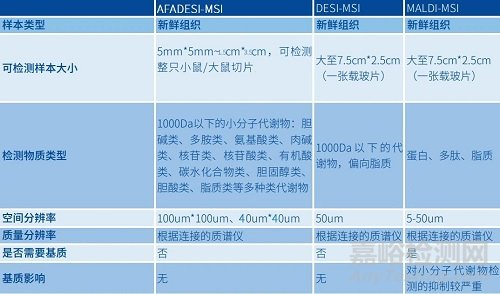

来源:Internet


