您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-04 21:08
《医疗器械生产质量管理规范无菌医疗器械实施细则》和《医疗器械生产质量管理规范植入性医疗器械实施细则》中第八章监视和测量规定:生产企业应当建立符合要求并与生产产品相适应的无菌检验室。实际工作中不仅有无菌实验室,还包括阳性对照室、微生物限度室等,统称为微生物实验室。本文对微生物相关的基础知识进行初步探讨。
1 微生物实验室简介
医疗器械实验室包括理化实验室和微生物实验室。
理化实验室应设检验装置,主要检测物理性能和化学性能;
微生物实验室,微生物检测按GB/T50073-2013《洁净厂房设计规范》、GB/T50591-2010《洁净室施工及验收规范》建立并实施;其中的生物学评价检验,企业一般不设检验室,而是委托检测机构进行检测。
微生物实验室应进行基础的实验:
(1)按照该产品的标准要求(GB/T14233.2《医用输液、输血、医用器具检验方法第2部分生物学试验方法》或中国药典),对产品进行无菌检验;
(2)对原材料、半成品、成品的初始污染菌检测;
(3)对洁净室(区)进行微生物限度检测,其中包括纯化水、台面、工作人员手等;
(4)细菌内毒素检查。
2 微生物实验室设计要求
微生物实验室设计包括:人员,培养基,菌种,器具及工作服清洗,实验室布局,洁净室换衣流程。
2.1 微生物实验人员
(1)应当是专职人员,并且是本专业或与产品相适应的专业人员;
(2)应当经过与岗位要求相适应的培训,具有相关的理论知识和实际操作技能;
(3)应当定期进行卫生和微生物学基础知识、洁净作业等方面培训;
(4)应当每年至少体检一次。患有传染性和感染性疾病的人员不得从事此工作。
2.2 培养基
培养基应具有良好的促进菌落生长能力,在规定的条件和环境下灭菌和贮藏,通过接种不同的菌种并观察生长状态,进行灵敏度试验和培养基适用性检查。
2.3 试验用菌种
菌株的采购、复活和传代应满足《中国药典》要求。实验室常用菌株采购一般为0代冻干粉、二代商用斜面菌株、定量菌株。
《中国药典》2020版所需菌株来源于CMCC(中国医学细菌保藏管理中心)。试验菌株的传代应严格控制,不得超过5代,防止过度传代增加菌种变异风险。菌株在培养基上培养一次,即为一代。
下表为实验室常用菌株及编号
|
序号 |
菌种名称 |
菌种编号 |
|
1 |
金黄色葡萄球菌 |
CMCC(B)26003 |
|
2 |
铜绿假单孢菌 |
CMCC(B)10104 |
|
3 |
枯草芽孢杆菌 |
CMCC(B)63501 |
|
4 |
生孢梭菌 |
CMCC(B)64941 |
|
5 |
白色念珠菌 |
CMCC(F)98001 |
|
6 |
黑曲霉 |
CMCC(F)98003 |
2.4器具及工作服清洗
实验器具:用纯化水清洗后(若有污垢,需用中性洗涤剂浸泡后,清洗干净,晾干),在121℃ 30min条件下,进行高压蒸汽灭菌处理。
工作服:不同洁净区域和阳性间的工作服和工作鞋每周至少洗一次,并且要分开清洗,整理。洗涤剂为洗衣液和消毒液,用纯化水洗涤。
2.5实验室布局
根据《中国药典》要求:单向流空气区域、工作台面及受控环境应定期按GB/T16292-2010《医药工业洁净室(区)悬浮粒子的测试方法》、GBT16293-2010《医药工业洁净室(区)浮游菌的测试方法》、GBT16294-2010《医药工业洁净室(区)沉降菌的测试方法》的现行国家标准进行洁净度确认。其中包括无菌实验室、细菌限度室、阳性对照间等。
洁净度
无菌实验室和细菌限度室应配置超净工作台,且符合洁净度10000级条件下的100级洁净度环境。在实验过程中应检查工作台洁净度,步骤包括:取3只已灭菌培养基,在超净工作台左、中、右位置各放1个,打开盖子并暴露30分钟,取出做好标注,放入30-35℃培养箱中培养48小时后检查,结果3只培养基生长的菌落数平均应不超过1个。
刚进入医疗器械行业,举例两种实验室布局类型:图1和图2。
图1
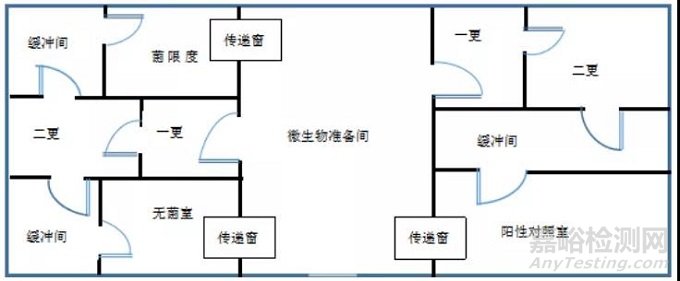
图2
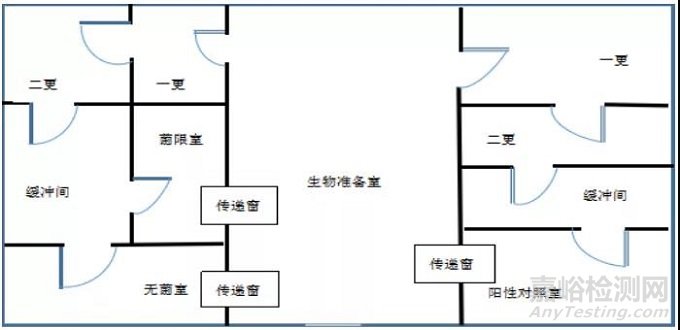
实验室布局设计的基本原则是既要最大可能防止微生物的交叉污染,又要防止实验过程对环境和人员造成危害。应充分考虑到微生物实验室操作规范和实验室安全要求。通常实验室划分成洁净或无菌操作区域和活菌操作区域,同时,根据试验目的不同,有效分隔不相容或相互产生干扰的实验活动,将交叉污染的风险降到最低。
2.6洁净室换衣流程
进出洁净室或实验室的更换衣服流程,洁净室或实验室人流通道和物流通道分开,避免出现交叉污染。物品进入洁净室必须通过传递窗进入,禁止和工作人员一起通过人流通道进入。
参考文献
《中国药典》四部
《医疗器械生产质量管理规范无菌医疗器械实施细则》
《医疗器械生产企业微生物实验室设计与监管实例》

来源:德大器械产业管家


