您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-12 22:26
一、前言
美国药典USP<60>收载了洋葱伯克霍尔德菌(以下简称Bcc菌)的相关要求及检测方法,FDA于 2021年9月发布了微生物控制的指南草案《Microbiological Quality Considerations in Non-sterile Drug Manufacturing》(非无菌药品生产中的微生物质量考量),里面也包括Bcc菌在内的相关要求,但现行版中国药典尚未收录Bcc菌的相关要求。为与国际接轨,同时更好控制产品的微生物质量,中国药典正在进行与Bcc菌相关内容的制修订工作。
二、我国微生物质量控制的发展趋势
考虑到要与国际接轨,国家药典委员会正在制修订微生物质量控制方面的通则内容,截图如下:
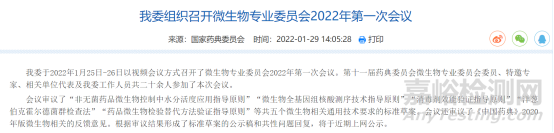
中检院也于今年5月份开展了微生物质量控制方面的相关培训,具体培训内容截图如下:

从以上内容可以看出:我国的微生物质量控制趋势正在与国际接轨,在非无菌药品微生物质量控制中引入水分活度的概念(关于水分活度的相关内容详见USP<1112>),使微生物质量控制更加科学;同时引入新型控制菌--Bcc菌的检查方法,逐步与FDA和USP趋同。关于Bcc菌的相关介绍详见下文。
三、洋葱伯克霍尔德菌(Bcc菌)的研究趋势
Bcc菌与现有的微生物限度检查并不冲突,Bcc菌是微生物限度检查的补充,它是一种有害微生物,属于控制菌的一种。在美国,Bcc菌是非无菌药品召回的首要原因。由于其危害性较大,美国药典及FDA近期出台的相关指南均重点关注了Bcc菌,在现有微生物限度检查(一般包括需氧菌总数、霉菌酵母菌总数及控制菌检查)的基础上对Bcc菌提出了新的要求,其具体检测方法详见USP<60>。现有的关于微生物限度检测所遵循的技术要求汇总如下表所示:
各国药典及ICH指南中关于微生物限度控制的对比
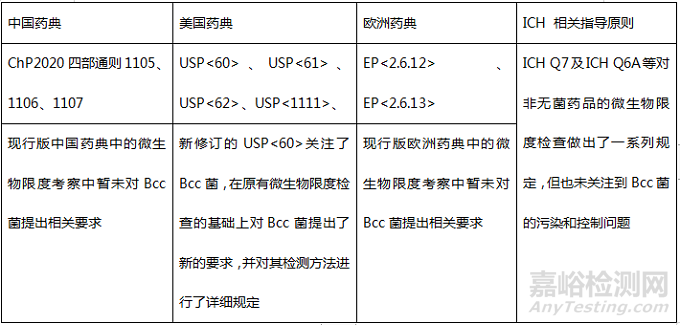
由于Bcc菌的危害性较大,我国于近期也开始关注水性非无菌药品中的Bcc菌污染问题。国家药典委已将Bcc菌控制纳入中国药典2020年版增补本(目前该标准草案处于审议阶段,可持续关注中国药典2020年版增补本的动态),2021年11月26日发布的《化学药品创新药上市申请前会议药学共性问题及相关技术要求》通告中规定:对于吸入、口服、粘膜、皮肤和鼻腔给药的水溶液非无菌制剂,一般应参照相关技术要求对Bcc菌进行研究,制定相应的控制策略。即,目前药典委和CDE均关注到了Bcc菌。
Bcc菌是一组革兰氏阴性菌,包括20多种有效菌种。该菌属于有害微生物之一,对免疫力低下的人群伤害较大,可能会引起感染甚至死亡。制药用水和生产过程中使用的天然成分是药品中Bcc菌的主要来源,即Bcc菌在固体制剂中出现的风险较小,其主要出现在水性非无菌药品中。由于Bcc菌污染而导致的不良反应事件及药品召回越来越多,所以建议生产商在生产水性非无菌药品时严格遵循GMP,以更好保证产品的微生物质量:
★为工艺操作的设计和控制建立风险管理计划,以防止Bcc菌污染;
★使用强悍的工艺用水系统(生产商必须对水系统进行稳健的设计,包括旨在防止有害微生物的控制措施以及用于监测、清洁和维护的程序);
★确保各组分均符合微生物负荷量的适当标准;
★对设备进行恰当的消毒和清洁;
★采用经验证的抽样程序,以定期对Bcc菌的存在进行中控检测和成品测试。
Bcc菌的危害性较大,为保证产品质量及患者安全,生产商在水性非无菌药品生产中需重点关注该菌的污染问题。我国监管部门也在近期出台了相关技术要求,在现有微生物限度检查的基础上,对水性非无菌药品中的Bcc菌提出新的要求,建议对水性非无菌药品开展Bcc菌检查和风险评估,以更好控制水性非无菌药品的微生物质量。
案例分析:洋葱伯克霍尔德氏菌(Burkholderia cepacia,以下简称Bcc菌)对口服溶液的污染
FDA执法报告(2012年至2019年)显示,Bcc菌是非无菌药物召回的首要原因,有102次。其中,2016年5月,美国疾病控制与预防中心(CDC)向FDA通报了涉及Bcc菌污染的9个州13家医院患者患严重疾病和死亡的案例,这款被Bcc菌污染的产品是一种用于治疗便秘的水性OTC药品。FDA和CDC的检测显示,超过10批口服液产品被Bcc菌污染。Bcc菌临床分离株与产品分离株相匹配。调查还发现,该公司用于生产该产品的水系统中含有Bcc菌。FDA和CDC确定合同生产商是这次污染的源头,设计不良的水系统(冷系统;不连续循环)、系统监控不足、生产控制不善以及微生物检测方法不充分,这些都给消费者带来了严重的风险。合同生产商生产的所有液体产品最终都被召回。
案例分析和讨论:制药用水和生产过程中使用的天然成分是药品中Bcc菌的最可能来源。因此,严格执行cGMP对确保产品质量和患者安全至关重要,包括设计良好的水系统、完善的生产过程控制及日常监测、经过充分验证的有效的微生物检测方法等等,通过以上控制措施,使水性非无菌药品免受Bcc菌污染,更好保证产品质量和患者安全。
四、小结
Bcc菌是一种新型的控制菌,中国药典尚未正式收录该控制菌。由于Bcc菌的危害较大,故建议生产商重点关注水性非无菌产品中的Bcc菌污染问题。在现有微生物限度检查的基础上,对水性非无菌药品中的Bcc菌提出新的要求,以更好保证药品的微生物质量及患者安全。由于Bcc菌的检测方法比较复杂,美国药典已在通则USP<60>中详细描述了Bcc菌的检测方法,建议中国药典也尽快将Bcc菌的检测列入制修订计划。
参考文献
1.Analysis of FDA Enforcement Reports (2012-2019) to Determine the Microbial Diversity in Contaminated Non-Sterile and Sterile Drugs. https://www.americanpharmaceuticalreview.com/Featured-Articles/518912-Analysis-of-FDA-Enforcement-Reports-2012-2019-to-Determine-the-Microbial-Diversity-in-Contaminated-Non-Sterile-and-Sterile-Drugs/
2.Microbiological Quality Considerations in Non-sterile Drug Manufacturing.FDA.2019-09. https://www.fda.gov/media/152527/download
3. USP<1112>.APPLICATION OF WATER ACTIVITY DETERMINATION TO NONSTERILE PHARMACEUTICAL PRODUCTS
4. 王似锦,余萌,胡昌勤,等.14 株伯克霍尔德菌的鉴定分析[J].中国抗生素杂志,2019,44( 10) : 1214-1219

来源:药事纵横


