您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-04 13:58
抗体的功能性取决于靶点的有效选择。膜蛋白作为治疗性抗体的靶点,在细胞信号转导和运输中发挥了关键作用,可用于疾病诊断及药物治疗领域。当前,膜蛋白在药物研发领域面临的挑战是需要进一步发掘膜蛋白潜在靶点的干预价值,开发治疗性抗体药物;而若要开发针对复杂膜蛋白(如GPCR、离子通道、转运蛋白和激酶)的抗体药物,必须从抗原靶点设计、抗体筛选策略、先导抗体优化及药物研发模式方面进行考虑。
中国工程院院刊《Engineering》2021年第11期刊发美国德克萨斯大学健康科学中心安志强教授研究团队的《靶向膜蛋白的抗体药物开发的新进展》一文。文章概述了抗体靶向复杂膜蛋白的优势与挑战,总结了膜蛋白抗原制备和抗体研发策略的最新进展。文章指出,膜蛋白的抗原制备作为关键技术之一,是开发有功能的靶向抗体的前提条件;第二个关键技术涉及抗体优化和抗体表达平台。抗体与小分子和多肽药相比有其独特的优势,膜蛋白参与了各种正常生理过程,其功能异常与多种疾病相关。此外,重点研究膜蛋白分子的抗体开发,将为一系列疾病诊断和治疗带来新的突破;需要制定选择靶向膜蛋白的指南,其中筛选治疗靶点进行单抗研发是未来技术革新的重要方向。
一、引言
根据抗体协会(Antibody Society)的名单,截至2021年9月,有127种抗体在美国和欧盟上市。其中,超过一半(77/127)以膜蛋白为靶标。然而,这些抗体中的大多数都是靶向具有简单跨膜区和较长胞外区(ECD)的膜蛋白,如酪氨酸激酶受体。仅有三种靶向结构复杂的膜蛋白,如G蛋白偶联受体(GPCR)。值得注意的是,获批药物中约40%通过靶向GPCR复合物发挥药理作用,体现了膜蛋白类治疗性抗体的开发潜力。事实上,离子通道、转运蛋白、GPCR和激酶是药物研发中最大的一类药物靶点。
业界和相关研究团队已有多篇关于膜蛋白抗体的优秀综述。本文主要探讨治疗性抗体研发现状和技术革新,以致力于研发和识别更复杂的膜蛋白抗体,包括GPCR、离子通道、转运蛋白和激酶。GPCR和离子通道是小分子化合物重要的作用靶点。分析2016年美国食品药品监督管理局(FDA)批准的药物靶标发现,GPCR和离子通道在小分子治疗药物中分别占比33%和18%。GPCR和离子通道是生物医药研究和临床研发高度关注的热点。如何选择膜蛋白靶点是小分子药物开发中遇到的一个关键问题,虽然小分子比抗体更容易到达作用部位,但抗体能有效识别复杂膜蛋白的胞外区。以CC趋化因子受体4(CCR4)为例,该基因编码的蛋白属于GPCR家族,CCR4抗体mogamulizumab批准用于治疗复发或难治性蕈样真菌病和Sézary综合征。另一个例子是预防偏头痛的药物erenumab,其抑制了降钙素基因相关肽受体(CGRPR)的生物活性。靶向膜蛋白的抗体制备策略之一是抗体工程化改造。当特定蛋白构象改变与疾病状况相关时,抗体药物在选择性、特异性和效应功能方面具有许多额外的优势,单克隆抗体BIL010t靶向非功能性的胞外ATP激活离子通道无功能的嘌呤受体P2X7(nfP2X7),目前正在利用该抗体进行治疗基底细胞癌的临床试验。抗体偶联药物通过改善药代动力学增加了药物活性, Gptx-1多肽毒素偶联抗体在有效阻断Nav1.7离子通道的同时延长了抗体半衰期,并能更好地作用于神经纤维。除了直接作用外,抗体还可以通过抗体依赖的细胞毒(ADCC)和补体依赖的细胞毒(CDC)等效应发挥功能。利用mogamulizumab证明了可通过改造抗体可结晶片段(Fc)区来提高药效和安全性。
蛋白质晶体技术和其他结构生物学手段有助于我们更好地解析膜蛋白的三维结构。模拟膜蛋白天然结构制备环状多肽抗原,从而成功研发靶向这些蛋白的治疗性抗体。抗体的分离纯化也得益于技术进步,大肠杆菌GroEL作为分子佐剂进行DNA免疫,诱导了针对靶向蛋白的特异性抗原,提高DNA免疫在体内激发抗体产生的效率。
膜蛋白靶向抗体药物的发展经历了四个关键技术。第一是分离稳定天然蛋白构象的抗原;第二是克服免疫耐受,即免疫系统对类似自身抗原结构不产生免疫应答;第三个关键点则需要考虑这些靶分子多样化的胞外区(抗体的作用区域);第四是筛选有效作用于膜蛋白功能位点的特定抗体。不同的研发策略以及新技术和新方法正被用于解决上述关键技术以开发更高效的抗体药物。表1列出了正在进行临床前研究和已用于临床治疗的膜蛋白靶点抗体药物。我们根据靶点类型、抗原结构、抗体形式和抗体生产平台将这些抗体进行分类,并给出配体、结合位点、作用机制、有效性、表位、治疗适应症和副作用等详细信息(表1)。
表1 靶向膜蛋白抗体研发的关键技术及面临的挑战
抗体工程技术提高了抗体结合靶抗原的特异性和有效性。改造抗体Fc区,能够减缓抗体药物的半衰期。此外,Fc区工程化改造还可以增强或减弱ADCC等Fc效应。膜蛋白通过其配体或其他相互作用的蛋白激活下游信号通路。许多膜蛋白抗体可有效识别并稳定GPCR和离子通道的结构域,影响其参与的多种细胞信号转导过程。
ClinicalTrials.gov、PubMed数据库和抗体协会的相关资料给出了目前处于临床前和临床开发中的膜蛋白靶向抗体,本文挑选了其中具有代表性的例子,探讨了靶向膜蛋白抗体的作用机制、膜蛋白抗原的制备以及抗体的研制。
二、膜蛋白抗体的作用机制
GPCR的胞外区介导受体与配体相互作用,激活的受体将信号传递到细胞内并招募下游效应蛋白。离子通道在细胞膜上形成一个孔道,疏水性氨基酸面向磷脂双层,离子可以通过这个通道穿过细胞膜的疏水核心。离子通道、GPCR和其他跨膜蛋白参与了许多重要的细胞生物学效应,其功能异常与多种疾病有关。因此,以它们为靶点开发的抗体在治疗和预防相关疾病方面有独特的优势。研发膜蛋白治疗性抗体的几个要素:结构高度保守是机体维持正常功能不可或缺的,因此针对这些靶点的干预手段具有更广的选择性;跨膜蛋白(离子通道,GPCR)和膜结合的激酶(基质金属蛋白酶)的结构多样性,为干预调节这些蛋白的特定功能提供了许多思路,更易于研发靶向特异性的治疗抗体;通过多种方式优化改造抗体自身复杂的结构可设计出针对多靶点的单抗药物。
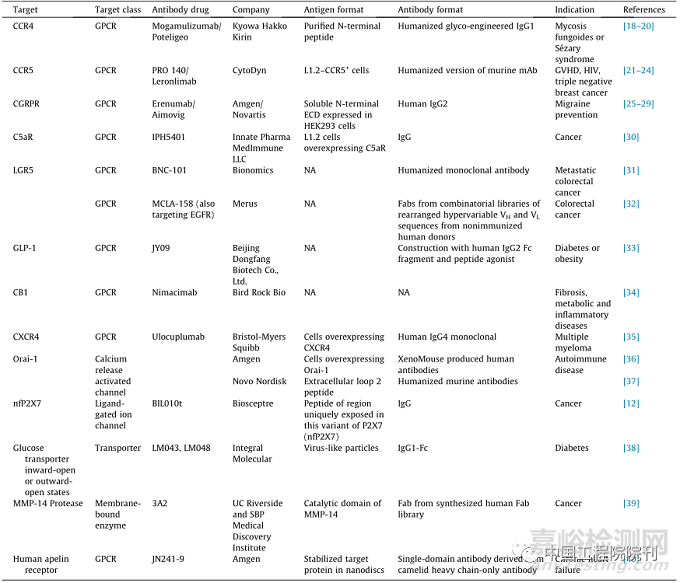
膜蛋白抗体与GPCR的结构及可能的互作位点如图1(a)所示。单抗与GPCR相互作用的一种方式是维持其活性状态。一项关于GPR56的研究利用激发型抗体阐明了GPCR信号对人脑胶质瘤发生、发展的作用。另外一种效果是单抗促进GPCR形成二聚体功能单元,研究人员发现代谢型谷氨酸受体7和β1肾上腺素能受体通过识别二聚体可有效激活GPCR。相对地,阻断型抗体可作为一种GPCR抑制剂,GIP是葡萄糖依赖性促胰岛素多肽,通过干预GIP-GIPR这一路径,有望治疗肥胖症和糖尿病患者。Mogamulizumab是靶向CCR4的人源化单克隆抗体,2018年被批准用于治疗淋巴瘤、Sézary综合征和蕈样真菌病,但未表现出显著的促进或抑制GPCR活性效应。Mogamulizumab通过清除肿瘤微环境中表达CCR4的肿瘤细胞以及肿瘤浸润的调节性T细胞发挥作用,通过Fc去岩藻糖基化加强了ADCC效应。靶向GPCR的单抗erenumab是一种降钙素基因相关肽(CGRP)抑制剂,结合和拮抗降钙素基因相关肽受体(CGRPR),2018年已被批准用于预防成人偏头痛。离子通道系列抗体的效应途径如图1(b)所示;抗体诱导细胞表面受体产生内化,钙释放激活钙通道调节分子1(Orai-1)与自身免疫炎性疾病相关,Orai-1蛋白形成了细胞膜钙离子通道,导致细胞外钙离子内流。钙离子信号传导对于T细胞活化和功能是必需的。针对结构复杂的膜蛋白靶点开发的单克隆抗体能够识别特殊构象[图1(c)],葡萄糖转运蛋白(GLUT4)单抗分为向内开放和向外开放的构象状态,对葡萄糖的摄取和代谢至关重要。抗体作用于膜结合激酶,通过改变重链长CDR-H3区域,到达配体结合位点以催化目标蛋白酶[图1(d)]。具有超长CDR-H3的抗体来源于免疫骆驼血清,或人工合成的CDR-H3类似结构。基质金属蛋白酶-14(MMP-14)就是一个长CDR-H3靶向作用的膜蛋白位点。人apelin受体(APJ)是慢性心力衰竭患者的治疗靶点。靶向apelin受体的抗体JN241-9属于A类GPCR,其N末端胞外区比B类GPCR更短。骆驼单域抗体突变体JN241-9是首个GPCR抗体激动剂,相对较长的CDR3区域易于与疏水核心结合。已有研究报道,治疗性抗体MEDI9447通过稳定非激活状态的构象和交联CD73二聚体,拮抗胞外5´-核苷酸酶(ecto-5´-nucleotidase, CD73)活性[图1(d)]。
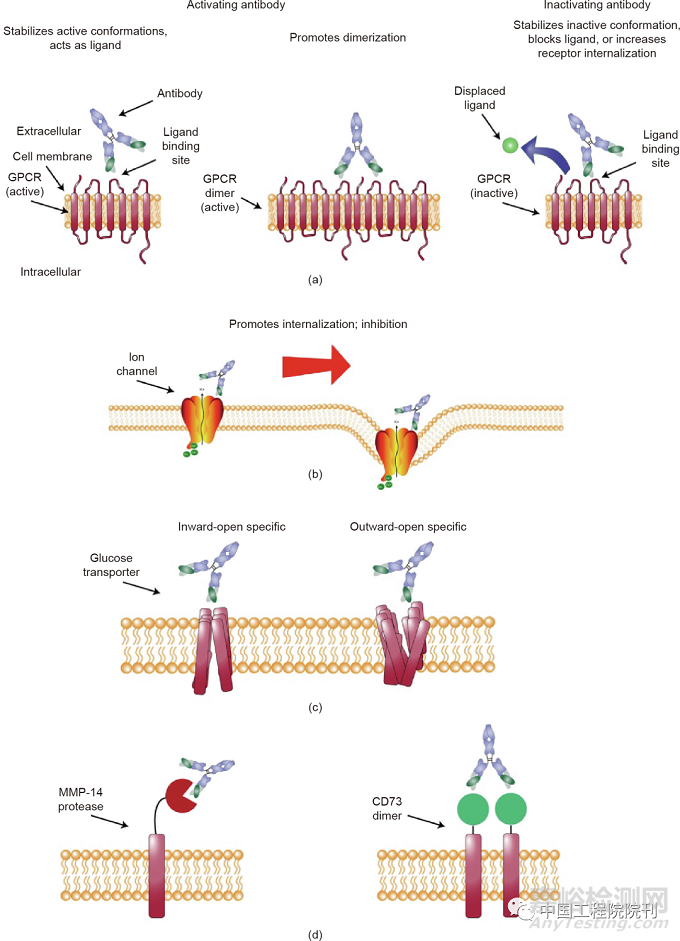
图1 靶向膜蛋白的抗体作用机制。(a)抗体激活GPCR,作为配体活化或促二聚化;抗体抑制GPCR,如与配体竞争位点。(b)促进内化是抗体靶向离子通道的一种方式。(c)靶向特定功能状态的特异性抗体,靶向细胞摄取葡萄糖的向内和向外开放状态。(d)左侧图表示抗体针对MMP-14的结合部位,右侧图为通过稳定无活性的构象(如CD73二聚体)来抑制酶的活性。
三、抗原制备
抗原制备是研制特异性调节膜蛋白功能的候选抗体的首要条件。理想的抗原应该包含与靶蛋白功能相关的所有关键位点,因此,膜蛋白抗原需具有相关作用的完整构象和转录后修饰;虽然不需要蛋白的完整分子,但抗体靶向表位的相关区域是必不可少的。
为了便于大量生产有活性功能的抗原,我们常常对抗原的某些结构进行调整优化,这些改变应注意保留蛋白结构的完整性和生物活性,包括整体构象、配体结合、膜表达、抗原加工和相关表位。选择治疗性抗体的靶点因不同种类的膜蛋白而有所差异,一般情况下,抗原识别位点在胞外环区和靠近N末端部位。膜蛋白胞内段是维持其结构和信号的传导区,如靶向GLUT4胞内功能区的LM043。膜结合激酶抗体竞争结合酶与底物的作用部位,抗apelin受体的JN241-9识别受体-配体结合位点。抗体药物偶联需要设计特定的抗原结合片段,单抗通过一个化学链与生物活性小分子药物相连,抗体和小分子作用于不同的靶点实现协同效应。鉴于膜蛋白的分子量和结构复杂性,靶向这些蛋白的抗体必须覆盖广泛的抗原表位。抗原的表达形式同样遵循一定的策略,充分了解靶蛋白的结构和功能,可参考已有抗体的类似靶点结构。膜蛋白靶标的分类基于蛋白行使功能的方式,如用离子通道的生理功能区分刺激-分泌耦合,根据序列、功能和系统发育分析对GPCR进行分组。开发新型抗原是探索膜蛋白生物功能和新药创制的突破口(图2)。新型的杯芳烃基表面活性剂和Salipro纳米膜技术为稳定生产膜蛋白抗原提供了新思路。
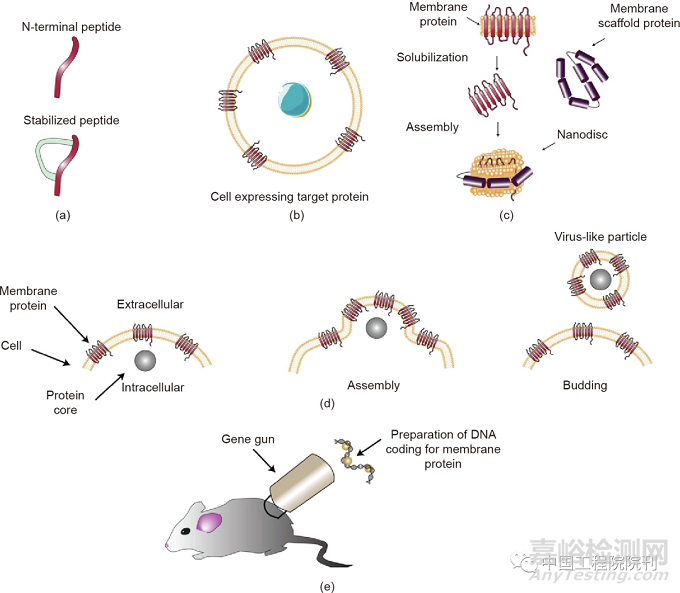
图2 选择抗原形式。(a)最简单的抗原形式是多肽,可以通过化学键或环化等方法形成稳定多肽;(b)细胞表达靶分子膜蛋白;(c)脂质纳米圆盘保留了膜蛋白的关键结构,避免产生非特异性抗体;(d)病毒样颗粒是一种保持膜蛋白天然构象产生抗原蛋白的方法;(e)用编码膜蛋白的DNA序列免疫动物提高动物免疫效率。
(一)多肽
多肽是最简单的抗原形式,成本低且易于大量生产。以下三种情况首选多肽抗原:①抗体只需要与受体结合就能阻断特定细胞功能;②目标细胞的靶分子胞外N末端直接参与其功能;③膜蛋白有较长的胞外区。GPCR靶向单克隆抗体(抗CCR4)和钙离子通道Orai-1抗体就使用了多肽抗原。之前的研究表明,让链状的多肽成环约束了多肽的活动,可获得与天然构象相似的稳定抗原[图2(a)]。例如,通过化学键将多肽装入CLIPS骨架,这项技术已成功用于趋化因子受体-2(CXCR2)抑制剂的研发。N末端未经修饰的线性多肽容易受到肽链外切酶的识别,改造后的环状多肽避免了酶降解失活,提高了多肽分子的稳定性[图2(a)]。
(二)细胞表达的模型多肽或蛋白
细胞膜的脂质环境保证了膜蛋白的正确折叠和活性,因此制备天然构象的膜蛋白抗原更易获得具有治疗功能的膜蛋白抗体。常用的方法有细胞表达多肽片段或靶蛋白、利用纳米盘制备膜蛋白抗体、利用具有较强免疫原性的病毒样颗粒和DNA免疫技术制备膜蛋白抗体。
利用细胞表达膜蛋白,必须保证宿主细胞产生有功能性的、正确折叠的抗原蛋白,并具备必要的翻译后修饰[图2(b)],同时选择适合高密度培养、瞬时转染表达量高的细胞系。MaxCyte瞬时电转染可快速生产大量抗原蛋白,对于转染率较低的表达载体也能纯化得到一定数量的膜蛋白。抗富含亮氨酸重复序列的G蛋白偶联受体5(LGR5)单克隆抗体就是通过将LGR5多肽与受体活性修饰蛋白(RAMP)共转染细胞来表达LGR5抗原。宿主细胞表达GPCR多肽或蛋白的细胞免疫方案也被用于研制离子通道抗体,合成Orai-1和P2X7多肽免疫动物,获得了离子通道的阻断型抗体。Orai-1单抗可治疗自身免疫性疾病患者,P2X7阻断剂对炎症性疾病有疗效。
(三)纯化膜蛋白技术——脂质纳米圆盘(nanodisc)和苯乙烯马来酸脂质颗粒(SMALP)
我们通常使用生物去垢剂分离和提纯膜蛋白,突变可以使去垢剂中的蛋白结构更加稳定。新型的纳米圆盘或脂盘可以提高膜蛋白折叠的准确率。APJ蛋白在昆虫细胞中表达并在纳米圆盘和脂质体中进行高水平重组,成功获得功能性APJ激动型抗体。SMALP溶剂也具有类似的效果。纳米圆盘和SMALP作为新型的膜蛋白表达技术,替代了传统去垢剂。纳米圆盘由支架蛋白和磷脂分子构成了类似磷脂双分子层结构,膜蛋白整合到纳米圆盘上[图2(c)],最大限度保留了蛋白的结构、功能和抗体识别的重要位点。
(四)病毒样颗粒和蛋白脂质体
其他模拟天然膜蛋白的抗原包括病毒样颗粒(VLP),是一种基于双层脂质的纳米结构,与纳米圆盘相比,它更趋近于天然细胞膜。病毒表达抗原蛋白技术与免疫方案的优化已被广泛用于靶向膜蛋白(GPCR、离子通道和转运蛋白)抗体的研发。用VLP表达抗原[图2(d)]免疫动物(鸡),获得了依赖型GLUT4抗体,用于研究GLUT4的生物学特性和糖尿病治疗。
(五)DNA免疫
在宿主体内注射编码抗原蛋白的DNA载体,使宿主既能表达膜蛋白,又产生针对该蛋白的抗体[图2(e)]。基因枪包被DNA颗粒,将其直接打入细胞并提呈给免疫细胞,辅以佐剂增强免疫反应。β1-肾上腺素受体单抗通过互补DNA(cDNA)免疫联合注射类固醇激素合成急性调节蛋白(StaR)增强动物免疫反应。大肠杆菌热休克蛋白作为DNA免疫的分子佐剂,与内皮素受体蛋白ETAR共同发挥作用。
四、抗体研制
膜蛋白作为治疗性抗体的靶点,可用于疾病诊断和治疗领域。其所面临的关键技术包括分析靶点蛋白的结构和功能、抗原制备方法,以及抗体的分离和纯化。膜蛋白抗体的技术瓶颈阻碍了抗体从实验室走向临床应用。
抗体研发人员需具备发现和开发不同靶分子抗体的技术、多样化的抗体分离纯化策略、亲和力成熟手段、人源化技术、ADCC增强技术等系统性优化抗体的工艺(图3)。
图3 膜蛋白抗体的来源。(a)多样化的候选抗体:免疫动物或构建天然或合成抗体文库。常用的动物有野生型小鼠、靶蛋白缺陷小鼠、人源化小鼠,特殊的免疫动物有绵羊、鸡、骆驼。人供体来源的单抗及其结构和功能分析构建天然或合成抗体库,克隆单抗的可变区序列并装入载体进行真核表达。(b)第二阶段是通过筛选噬菌体文库、传统杂交瘤技术、B细胞克隆方法,从大量候选抗体中分离出最有希望大规模生产的单抗。(c)在候选抗体中进一步通过基因工程技术(去糖基化和构建不同形式的抗体)优化抗体功能,产生不同免疫球蛋白G(IgG)亚型的单抗、抗原结合片段(Fab)抗体、单链抗体、结构域抗体、双特异性抗体以及抗体偶联药物、寡核苷酸或放射性元素。RT-PCR:逆转录聚合酶链反应;FUT8:α-1,6-岩藻糖基转移酶。
开发先进的抗体研发技术有助于更高效地进行抗体分离,抗体分离技术的进步也推动了开发难度较高的膜蛋白抗体的研发进展。
(一)源于动物和文库的抗体——稀有抗体的获得
抗原免疫动物是获得抗体的重要手段,因此宿主动物的选择也是重要的一环[图3(a)]。野生型老鼠是一种常用动物,GPCR S1P3是脂质信号分子。通过S1P3肽段免疫小鼠研制的EDD 7H9单抗对S1P3受体有拮抗作用,能够抑制小鼠乳腺肿瘤生长及缓解败血症。前文提到的Orai-1是钙释放激活通道调节分子,小鼠抗Orai-1单克隆抗体用于治疗自身免疫性疾病。合成Orai-1胞外环(ECL2)多肽免疫野生型BALB/c小鼠,诱导小鼠产生靶向Orai-1的阻断抗体。另外采用过表达Orai-1的转基因细胞免疫人源小鼠产生了靶向Orai-1 ECL2段的抗体。
除了野生型BALB/c小鼠,我们还会用到靶蛋白缺陷型小鼠。胰高血糖素样肽受体(glucagon-like peptide-1 receptor, GLP1R)是治疗2型糖尿病的有效靶点。GMA102和GMA105单抗针对GLP1R位点,纯化的GLP1R蛋白胞外段免疫GLP1R基因敲除小鼠,随后将抗体的重链可变区(VH)和轻链可变区(VL)序列连接载体,转染真核细胞HEK293-6E,表达目标单抗并鉴定其功能。目前两种单抗已经进入临床I期,用于治疗2型糖尿病和肥胖症患者。
除了野生型小鼠和特定靶蛋白缺陷小鼠外,我们还可以通过具有人免疫球蛋白基因的小鼠模型获得全人源抗体。这类基因工程小鼠在保留小鼠免疫系统的同时,产生人源抗体。Douthwaite等使用VelocImmune小鼠平台开发了抗甲酰肽受体1 (FPR1)的治疗性单克隆抗体,并采用噬菌体文库完成抗体亲和力成熟。FPR1单抗被用于治疗炎症相关疾病。通过将纯化多肽注射到转基因小鼠体内,对GPCR抗体erenumab和REMD-477进行血浆分离并筛选高亲和力的人源抗体。Orai-1人源抗体也来源于血浆纯化。全人源抗体转基因小鼠平台Medarex KM被用于研制C-X-C基序趋化因子受体4(CXCR4)抑制剂ulocuplumab。该抑制剂正在进行临床I期试验,用于治疗血液系统恶性肿瘤。
研发难以获得的膜蛋白单抗,往往需要选择非小鼠的特定的免疫动物。Biosceptre公司的nfP2X7抗体通过了治疗基底细胞癌患者的I期临床试验,nfP2X7是三磷酸腺苷(ATP)门控离子通道P2X7的一种异构体,nfP2X7蛋白具有裸露在外的一段特殊肽段,利用这段多肽结构免疫绵羊产生特异性抗体。系统发育分析表明,鸡与人同源性较远,因此免疫鸡分离候选抗体有着广阔的应用前景。骆驼血清是纳米抗体的来源,CX3CR1是一种参与CD8+T细胞募集的趋化因子受体,与肾脏疾病相关。CX3CR1抗体分离自骆驼。克隆骆驼单抗可变区基因,构建噬菌体抗体库,以Apelin受体APJ为靶点,在构建的抗体展示文库中分离APJ激动型抗体。构建人源抗体以及合成抗体的噬菌体文库[图3(a)]是研制膜蛋白抗体的有效途径。人源抗体文库从人供体分离B淋巴细胞,再提取可变区序列。人工合成抗体文库则根据生物信息学的结构分析,设计有效的抗体序列,将扩增或人工合成的抗体CDR序列克隆到载体上,转染表达宿主。
各种动物来源抗体都可以通过杂交瘤技术或B细胞克隆分离出具有特定功能的罕见单抗[图3(b)]。传统的杂交瘤技术将骨髓瘤细胞与分泌特异性抗体的B细胞融合,筛选杂交瘤细胞分泌单抗,识别特定抗原蛋白。
(二)抗体形式的修饰
获得针对复杂膜蛋白的抗体后,随之必须解决的问题是治疗性抗体形式的精细化改造,以进一步提高疗效和特异性。图3(c)提供了一些精细化方法。例如,糖工程化技术敲除α-1,6-岩藻糖转移酶(FUT8)基因,去除了抗体Fc段的岩藻糖,去糖基化抗体对Fc受体具有更高的亲和力,增强了单抗药物的ADCC和CDC活性。采用无核心岩藻糖单抗的POTELLIGENT®技术,在FUT8的敲除细胞中表达的mogamulizumab单抗是第一款去糖基化修饰的抗体药物。
抗体形式精细化的另一途径是,可以使用不同形式的抗体,研制针对复合物或复杂膜蛋白的抗体药物,如不同的IgG亚型、抗原结合片段(Fab)、单链抗体片段(ScFv)、单域抗体、纳米抗体、双特异性抗体和偶联抗体[图3(c)]。
五、总结
本文讨论了近年来抗体工程的技术革新以及靶向膜蛋白的治疗性抗体的研究进展。膜蛋白的抗原制备作为关键技术之一,是开发有功能的靶向抗体的前提条件。第二个关键技术涉及抗体优化和抗体表达平台。抗体与小分子和多肽药相比有其独特的优势,膜蛋白参与了各种正常生理过程,其功能异常与多种疾病相关。因此,重点研究膜蛋白分子的抗体开发,将为一系列疾病诊断和治疗带来新的突破。治疗性抗体领域的新兴技术层出不穷,本文或许无法一一探讨,文中列举的技术方法是基于作者对治疗性抗体开发的理解和概括,希望对改进靶标抗原制备和抗体生产优化提供参考。
另外,需要制定选择靶向膜蛋白的指南。筛选治疗靶点进行单抗研发是未来技术革新的重要方向。结合临床试验和亲和力测定,进而在体内外验证抗体活性。抗体的功能性取决于靶点的有效选择,抗原结构的微小变化影响了单抗的特异性识别。例如,为了抑制钙释放激活通道Orai-1(其目的是缓解自身免疫性疾病),抗体的体外检测涉及钙离子流量、电流幅度、细胞周期分析、T细胞活化和细胞因子检测。利用人源化移植物抗宿主病(GVHD)小鼠模型在体内观察Orai-1抑制剂治疗GVHD的效果。通过对膜蛋白结构进行分析,研制人Apelin受体激动剂抗体JN241-9,进而测定环腺苷3´,5´-单磷酸(cAMP)信号通路;通过病毒转导β-arrestin(一种细胞质蛋白)报告细胞,构建细胞表面抗体展示文库。针对β1肾上腺素受体激动剂,需检测细胞内cAMP水平,采用酶互补法检测β-arrestin通路活性。利用cAMP水平变化评价大麻素受体1(CB1)激动剂抗体的效价。抗缓激肽B2受体(BKB2R)单克隆抗体的活性通过抗体诱导细胞中糖原合成酶激酶3(GSK-3)磷酸化进行评估。现有技术和理论进步已经使膜蛋白治疗性抗体在研发、纯化、筛选和改造方面有了长足的进步,相信在不久的将来会有更多靶向膜蛋白药物被用于疾病预防与临床治疗。

来源:中国工程院院刊


