您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-04 09:42
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.泽布替尼新适应症在欧盟获批。百济神州自主研发的BTK抑制剂百悦泽(泽布替尼)的新适应症获欧盟委员会(EC)批准,用于治疗既往接受过至少一种抗CD20疗法的复发/难治性(R/R)边缘区淋巴瘤(MZL)成人患者。在Ⅱ期临床中,泽布替尼取得高达68%的总缓解率,其中完全缓解率为26%。今年10月,欧盟CHMP还发布积极意见,建议批准泽布替尼用于治疗慢性淋巴细胞白血病(CLL)。
2.恒瑞「吡咯替尼」拟纳入突破性疗法。恒瑞医药HER1/HER2/HER4酪氨酸激酶抑制剂马来酸吡咯替尼片获CDE拟纳入突破性疗法,联合曲妥珠单抗和多西他赛一线治疗HER2阳性、晚期复发或转移性乳腺癌患者。今年8月,该新药联合曲妥珠单抗和多西他赛一线治疗HER2阳性复发/转移性乳腺癌的III期临床(HR-BLTN-III-MBC-C研究)达到主要研究终点。吡咯替尼试验组与对照组相比,主要研究终点研究者评估的PFS达到24.3个月(vs10.4个月,HR=0.41)。
3.诚益口服GLP-1激动剂获批临床。上海诚益生物自主开发的GLP-1受体激动剂ECC5004获FDA临床许可,即将在美国开展I期临床,评估用于健康受试者和2型糖尿病受试者中的安全性、耐受性、药代动力学和药效学。ECC5004是一款新型口服小分子药物,已在临床前研究中显示出良好的疗效和安全性。目前,几乎所有获批的GLP-1受体激动剂都需要皮下注射,小分子GLP-1受体激动剂有潜力成为许多代谢适应症的基础治疗方案。
4.赛诺菲RIPK1抑制剂在华报IND。赛诺菲1类化药SAR443122硬胶囊的临床试验申请获CDE受理。SAR443122是赛诺菲从Denali公司引进的一款RIPK1抑制剂,拟用于治疗一系列神经系统疾病和全身炎症性疾病。目前,赛诺菲正在海外开展两项Ⅱ期临床试验,评估该新药用于治疗中重度亚急性或盘状/慢性皮肤红斑狼疮,以及用于治疗中重度溃疡性结肠炎的有效性和安全性。
5.阿斯利康ASO疗法在华报IND。阿斯利康1类化药AZD2693的临床试验申请获CDE受理,适应症为非酒精性脂肪肝炎。AZD2693是Ionis公司开发的一种靶向patatin样磷脂酶结构域蛋白3(PNPLA3)基因的寡核苷酸疗法,阿斯利康拥有该新药的开发和商业化授权。在临床前研究中,靶向PNPLA3的反义寡核苷酸(ASO)疗法在小鼠模型中显示出降低肝脏炎症和纤维化的治疗潜力。
国际药讯
1.吉利德乙肝新药获FDA批准用于儿童。吉利德乙肝新药Vemlidy获FDA扩展适用范围,用于≥12岁慢性乙型肝炎儿科患者的治疗。Vemlidy是一款tenofovir靶向前体药,是一种新型核苷类逆转录酶抑制剂(NRTI),已于2016年11月获FDA批准上市。该药物已被美国肝病研究学会(AASLD)与欧洲肝病学会(EASL)推荐作为患有慢性乙型肝炎并带有影响肝功能的肝脏疾病患者的一线疗法。
2.GSK佐剂RSV疫苗获FDA优先审评资格。FDA受理葛兰素史克针对老年人的佐剂RSV候选疫苗RSVPreF3 OA的生物制品许可申请(BLA),并授予优先审评资格,PDUFA日期为明年5月3日。在一项Ⅲ期临床AReSVi-006中,经独立数据监测委员会(IDMC)评估,该疫苗在60岁及以上老年人群中的有效性高达82.6%(96.95% CI:57.9-94.1),可避免RSV引起的下呼吸道疾病。欧盟和日本监管部门已受理该疫苗的上市申请。
3.MC4R激动剂获突破性疗法认定。Rhythm公司黑皮质素4受体(MC4R)激动剂setmelanotide获FDA授予的突破性疗法认定,用于治疗下丘脑性肥胖。公布在ObesityWeek 2022会议上的一项Ⅱ期临床数据显示,setmelanotide治疗在第16周时,使下丘脑性肥胖症患者的BMI平均降低了17.2%。2020年,Imcivree(setmelanotide)首次获得FDA批准上市,用于POMC、PCSK1或LEPR缺陷型肥胖症的治疗。在中国,琅钰集团拥有该新药的开发和商业化授权。
4.DMD抗体偶联寡核苷酸药物获快速通道资格。Dyneg公司抗体偶联寡核苷酸药物DYNE-251获FDA授予快速通道资格,用于治疗51号外显子跳跃突变的杜氏肌营养不良症(DMD)患者。DYNE-251可靶向结合目标肌肉组织中高度表达的转铁蛋白受体1(TfR1),通过促进外显子的跳跃,使肌肉细胞产生短且具有功能的肌肉营养不良蛋白,从而阻止或逆转疾病的进程。目前,该新药处于I/II期临床开发当中。
5.强生与免疫肿瘤学公司达成合作。杨森与Sonnet Bio公司就后者即插即用式全人源白蛋白结合(FHAB)技术平台开发的3款候选产品SON-1010、SON-1210和SON-1410达成合作协议。杨森将结合其细胞疗法,进行候选产品的头对头研究。在B16F10肿瘤小鼠模型中,IL12-FHAB(SON-1010)较IL-12疗法显示出增加30倍的抗肿瘤效力。而对比单特异性的IL12-FHAB,等量的双特异性药物IL12-FHAB-IL15(SON1210)和IL-18-FHAB-IL12(SON1410)具有协同抗肿瘤效力。
6.诺和诺德2022年Q3业绩出炉。诺和诺德发布Q3财报,前3个季度公司总营收1288.62亿丹麦克朗(约171.13亿美元),同比增长16%;糖尿病和肥胖领域的销售额达到1131.73亿丹麦克朗(约150.29亿美元),同比增长18%。其中,用于减肥适应症的司美格鲁肽产品Wegovy(每周1次皮下注射2.4mg)前三季度销售达到37.42亿丹麦克朗(约4.97亿美元)。诺和诺德预计将于今年底在美国推出Wegovy的所有剂量版本。
医药热点
3.阿根廷首次出现“超级真菌”感染病例。11月2日,阿根廷卫生部发布通告称,该国首都布宜诺斯艾利斯市近日发现两例感染“超级真菌”(俗称耳念珠菌,学名耳道假丝酵母菌)的确诊病例。这是阿根廷首次发现此类传染病。据悉,“超级真菌”感染致死率高,主要是通过接触受污染的环境或被感染者而传播。此种菌类生存能力强,很难用一般消毒方法杀灭。最好的防控方法是隔离确诊病例,阻断感染链条。目前,阿根廷防疫机构的专家已召开紧急会议,研究防控可能出现的“超级真菌”疫情。
评审动态
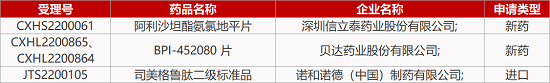
1. CDE新药受理情况(11月03日)

来源:药研发


