摘要:与传统注射剂和口服制剂相比,透皮贴剂具有避免首过消除效应、维持稳定的血药浓度以及提高患者的用药依从性等许多优势,其研发和产业化发展近年来受到了广泛的关注,但经皮吸收这一过程的存在使得透皮贴剂的生物利用度难以达到临床要求。因此,如何改善药物的经皮渗透以及如何评价药物的体外渗透成为透皮贴剂开发的关键和难点。本文结合国内外相关文献将现阶段透皮贴剂的促透方法及其机制进行归纳,为开发新的促透方法,提高药物的生物利用度提供思路;同时总结了体外渗透试验主要方法及常用皮肤模型、用于体外渗透分析的成像技术等,为解决目前关于透皮贴剂渗透性存在的诸多问题与挑战,制定更为完善的关于透皮贴剂渗透性的要求和标准提供参考。
贴剂系指原料药物与适宜的材料制成的供贴敷在皮肤上的,可产生全身性或局部作用的一种薄片状柔性制剂,可用于完整皮肤表面,也可用于有疾患或不完整的皮肤表面,其中用于完整皮肤表面能将药物输送透过皮肤进入血液循环系统起全身作用的贴剂称为透皮贴剂[1]。透皮贴剂起源于美国1979年上市的东莨菪碱透皮贴剂(商品名:Transderm Scop®),此后,尼古丁、可乐定、雌二醇等的透皮贴剂产品陆续上市。与传统注射剂和口服制剂相比,透皮贴剂具有许多显著优势[2],例如:①可避免肝脏的首过消除效应,提高治疗效率;②避免药物对胃肠道的刺激;③维持稳定的血药浓度,从而降低毒副作用的发生;④减少给药次数,提高患者的用药依从性,特别适合婴儿、老人以及有昏迷等情况的患者;⑤出现问题可及时中断给药等。
对于透皮贴剂及其他经皮给药制剂来说,皮肤都是一道难以透过的屏障,皮肤致密的角质层结构的存在,使大部分药物不能被吸收进入体内,而被滞留在皮肤内,生物利用度达不到临床要求。经皮吸收这一过程的存在也使得传统的药物释放方法并不完全适用于透皮贴剂等经皮给药制剂。因此,如何改善药物的经皮渗透以及如何评价药物的体外渗透成为透皮贴剂开发的关键和难点。
1、皮肤的构造和生理功能
人体最大的器官就是皮肤,约占体重的15%,抵御外源性暴露的屏障特性和维持动态平衡是皮肤的两大主要功能。皮肤可分为表皮、真皮和皮下组织,是一个复杂的多层结构体,尽管皮肤在整个身体结构上是连续的,但根据个体的年龄和解剖部位不同,皮肤的厚度也会有所不同,皮肤各层的基本特点和功能见表1[3]。
2、 透皮贴剂中药物促渗方法
药物作为外源性物质,需要通过经皮吸收才能进入体内,由于皮肤屏障的存在,特别是角质层的存在,大多数药物无法直接透过皮肤进入体内,在生物利用度上透皮贴剂很难与其他制剂相同,这就在一定程度上限制了它的发展,为了扩展用药范围,诞生了许多促透方法。
2.1 物理方法
常用的物理促透方法包括电穿孔、离子导入法以及超声导入法。电穿孔是通过电脉冲使细胞膜等脂质双分子层形成暂时、可逆的亲水性孔道,药物经过孔道进入皮肤而被吸收的技术[4];离子导入是通过电位差,使药物通过电渗流移动,不破坏皮肤屏障[5];超声导入法是指利用超声波的能量使药物透过皮肤,可实现在短时间内增加药物透皮吸收[6]。Vaidya等[7]自制了甲氨蝶呤贴剂,比较了甲氨蝶呤贴剂与3种物理促渗方法(超声导入、电穿孔和冷激光)相结合后的渗透情况,依次是超声导入>电穿孔>冷激光,相关药效学试验也表明在类风湿性关节炎的治疗中,使用超声导入作为促渗技术配合甲氨蝶呤贴剂有着更为显著的效果。
2.2 化学渗透促进剂
化学渗透促进剂是透皮贴剂常用的促透方法,原理一般是削弱角质层的屏障作用从而增强药物的渗透能力。化学渗透促进剂可以进入到角质层,并与其成分相互作用,暂时降低角质层的屏障作用,而不会对细胞造成重大损害。另一方面,化学渗透促进剂也可以改变配方的性质以促进药物渗透。第一个专门用来作为化学渗透促进剂而设计的化合物是月桂氮卓酮,于1976年获得专利。理想的化学渗透促进剂应具备以下条件[8]:①特异性(增加药物的渗透性,而不在体内有其他药理活性);②无毒性、无刺激性、无过敏性;③起效快、去除后角质层能恢复其屏障作用;④不对内源性物质造成损伤;⑤与药物和配方辅料相容。按照促透剂的结构,可将化学渗透促进剂分为亚砜类、脂肪酸类及其酯类、酰胺类、醇类、表面活性剂等。常见化学渗透促进剂及其应用药物见表2[9]。
2.3 新型载体的应用
使用物理方法促进药物渗透,患者依从性较差,成本昂贵;促渗剂的使用可能会引起皮肤刺激和皮肤损伤,而通过制剂技术研究的新型载体可以提高药物的溶解度、改变药物的结构或者使用特定结构包裹药物,从而增强药物透过皮肤能力的性能,使更多的药物能够开发成透皮贴剂。常见的透皮贴剂载体主要有立方纳米载体、脂质体、微针等。
立方纳米载体是由单油酸甘油酯构成的纳米颗粒,具有晶格膜结构,稳定性高。立方纳米载体促进药物渗透的机制可能是它可以扰乱皮肤角质层结构的有序性,提高皮肤角质层流动性[10]。另外,立方纳米载体与皮肤的结构相似,皮肤中也可能存在完整结构的立方纳米载体,并在药物经皮吸收中发挥重要作用,所以立方纳米载体促进药物渗透很可能依赖于整个载体的“携带”作用[11]。Salah等[12]构建了一种依托度酸立方纳米载体,通过经皮给药途径在靶点提供稳定的依托度酸浓度,持续时间更长,给药频率低,具有良好的控释性,与口服给药相比,依托度酸立方纳米载体提高了依托度酸的生物利用度。Mohyeldin等[13]以黄体酮为模型药物,制备了4种纳米载体:立方纳米载体、纳米脂质体、纳米乳剂和纳米胶束,并采用Franz扩散池进行了体外皮肤渗透,证明了与其他纳米载体相比,立方纳米载体具有较高的经皮渗透能力,同时通过激光共聚焦扫描显微镜和组织病理学发现立方纳米载体能够穿透整个皮肤层且具有良好的生物相容性。
脂质体是由两亲分子组成的具有双层构象的囊泡,具有较高的亲水性和亲脂性、无毒可生物降解并且容易大规模制备,类似于生物膜,主要成分通常是磷脂。脂质体是改善难溶性和大分子药物经皮递送的有利载体,脂质体的表面电荷、膜流动性和脂质组成等会对药物的经皮渗透造成影响,但传统脂质体通常容易聚集在角质层,无法穿透完整的皮肤,可考虑制成可变形脂质体如醇质体、转移体等促进其经皮渗透。此外,还可考虑将物理促透方法如离子导入等与脂质体结合,为透过皮肤屏障提供驱动力[14]。Salimi等[15]将脂质体作为利斯的明经皮给药系统的载体,采用薄膜水化法和超声法制备了50~150 nm的利斯的明脂质体并进行了处方优化,优化后的利斯的明脂质体在外用48 h后有90%以上的药物通过皮肤,并且由于脂双层的存在对药物释放有阻隔作用,可实现在较长时间内释放利斯的明。Abd El-Alim等[16]开发了2种二氟尼柳经皮纳米囊泡载体:醇质体和转移体,并与传统脂质体进行了比较,结果表明,二氟尼柳的2种载体在皮肤渗透时有着显著的优越性,并且分布更广,表现出显著的治疗疼痛和抗炎作用,被认为是二氟尼柳经皮给药有希望的载体。
微针穿透皮肤角质层进入皮肤后可形成微小孔道,药物通过这些微小孔道进入皮肤,从而达到促进经皮渗透的效果。Lopez-Ramirez等[17]构建了一种主动微针递送平台,采用加载在微针贴片中一种金属微粒作为引擎,实现更深、更快的皮肤递送。他们也提出了一种双作用组合可编程微针贴片,与传统微针贴片相比,该组合贴片可在几分钟内更快地传递药物并且释放可调节[18]。微针在突破皮肤屏障的同时极大地减轻了患者给药时的痛苦,在促进药物透皮吸收领域中的应用越来越广泛,但仍有一些问题需要解决,例如微针是否能滞留在皮肤里以及滞留的时间长短、对皮肤的刺激较大、可能发生过敏反应等[19]。
3、 透皮贴剂的体外渗透试验
体外渗透试验是为了模拟药品在生理条件下的透皮过程,以部分地反映药品的质量与临床治疗的有效性,是透皮贴剂质量控制中的重要一环,开发合理的体外渗透性检测方法也是透皮贴剂质量评价过程中的重要内容。目前透皮贴剂体外渗透试验主要方法是Franz扩散池法。
3.1 常用扩散池的种类
目前用于体外渗透试验的扩散池有静态扩散池和动态扩散池两种。静态扩散池包括立式扩散池和水平式扩散池,均由供给室、接收室、取样口、温度控制夹套和搅拌装置五部分组成。立式扩散池一般指Franz扩散池(Franz Diffusion Cell),是体外渗透试验的常用装置,该装置中供给室和接收室上下对合而成,上层为供给室,下层为接收室,两室之间用合成膜、动物皮肤或人的皮肤隔开,接收室的接收介质恰好与合成膜或者皮肤的真皮层接触,接收室中存在的搅拌装置以一定速率搅拌接收介质,使药物与接收介质能够混合充分[20]。水平式扩散池一般指Vilia-Chien扩散池(Vilia-ChienDiffusion Cell),供给室和接收室由左右两个对称的玻璃半室组成,均有温度控制夹套和搅拌装置以保证两室的温度和搅拌速度相同,常用于药物在皮肤中的扩散系数和渗透系数的测定[21]。动态扩散池一般指流通式扩散池(Flow Through Cell),由供给室、接收室和泵组成,泵的存在可以实现接收室内介质的持续流动,优化漏槽条件的同时可以更好地模拟皮肤内的微环境,对于溶解度较低的样品具有重要意义[22]。
此外,还可以采用MIVO®(Multi In Vitro OrganDevice)等新型的流体动力学平台进行体外渗透试验。MIVO®是一种一次性细胞培养室,能够在生理条件下容纳活组织(细胞层、3D重建组织等)或人造膜,进行体外渗透试验时可用皮肤或皮肤代替物将该系统隔成供给室、接收室,接收室连接可引起单向流动的蠕动泵,同时可设置合适的流速模拟真实的生理条件[23]。
3.2 皮肤模型的选择
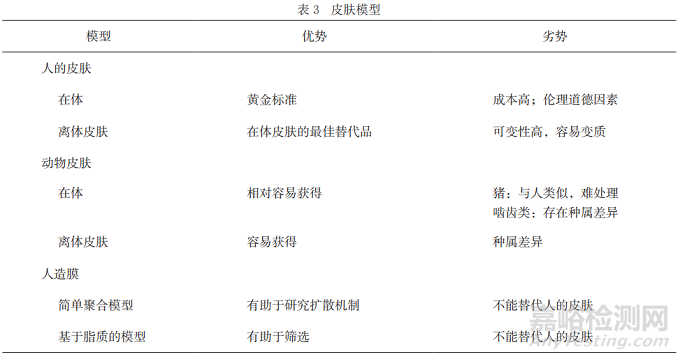
体外渗透是评价透皮贴剂的一个重要方面,如果药物是为了给人类使用,体外渗透试验最合适的皮肤模型就是人体皮肤。但是,由于道德或者经济方面的原因,特别是在药物研发的早期阶段,这几乎是不可能的。因此,找到与人类皮肤接近的代用品是非常必要的。表3[24]列出了一些常用于评价药物体外渗透的皮肤模型。
目前,常使用动物皮肤模型来评估药物的体外渗透,这些动物主要包括猪、小鼠、大鼠、豚鼠和蛇,其中猪皮和鼠皮较为常用,猪皮在组织学上与人类皮肤相似并且相对容易获得,啮齿动物中大鼠皮肤在结构上与人体皮肤最为相似,但通常比人体皮肤更具渗透性。动物皮肤模型在前期的一些基础研究中发挥重要作用,使我们对各种药物穿过皮肤屏障的过程、途径和驱动力有更好的理解。然而,由于不同物种间差异的存在以及所使用的试验方法的差异,结果可能存在较大的差别,例如皮肤部位、皮肤温度、皮肤厚度等都会对试验结果造成影响,从而影响进一步的分析。
此外,用于透皮贴剂体外渗透研究的还包括基于硅树脂的人工膜,这种人工膜易于处理和储存,可重复性高,是体外皮肤的理想替代品。但人工膜通常缺乏类似角质层的屏障特性,所以并不能完全替代人类或动物皮肤来预测皮肤吸收。
3.3 温度及接受液的选择
在体外渗透试验中,接收液的目的是代替皮肤的微环境,所以接收液的温度一般设定为皮肤表面温度32 ℃或者人体温度37 ℃。理想的接收液要求满足漏槽条件以及尽量接近皮肤微环境,人体血浆的正常pH值一般在7.35~7.45,接收液的pH值应尽量接近此范围,并结合药物的理化性质、处方工艺等因素综合考虑。此外,还要根据给药时间的长短考虑是否在接收液中加入合适的防腐剂,以防止药物或皮肤被微生物污染[25]。
4、利用成像技术分析体外渗透
透皮贴剂在皮肤中的渗透行为不仅影响其渗透速率,还可以反映其安全性和有效性,然而相关的理论和试验并不能完整地反映渗透行为。利用成像技术可以获得药物经皮吸收后在皮肤中的空间分布信息,以探索透皮增强机制,揭示局部药物与皮肤相互作用的机理,帮助更好地了解透皮吸收这一动态过程。但并不是所有的成像技术都可以用于分析透皮贴剂的体外渗透行为,例如荧光标记虽然能够追踪待测物的动态过程,但其荧光标记的分子量通常远高于透皮贴剂药物的分子量,并且荧光标记不可避免地会改变待测物的动态行为,对结果造成干扰;光声成像、光学相干断层扫描、高频超声成像等可以说明皮肤形态结构,但不能对待测物进行特征分析,目前用于分析透皮贴剂体外渗透行为的成像技术主要有红外光谱、拉曼光谱以及质谱成像[26]。
4.1 红外光谱成像
傅立叶变换红外光谱成像(Fourier TransformInfrared Spectroscopy,FT-IR)是传统红外光谱学的扩展,将FT-IR光谱仪与配有阵列检测器的光学显微镜结合,可以评估待测物在皮肤、组织和细胞内的相对数量和分布[27]。应用FT-IR时,不同波长的红外光会被皮肤或组织中的不同化学键(例如C=O、C-H等)吸收,而这些化学键与生物分子(例如脂质、DNA、蛋白质等)的存在和组成有关,FT-IR图像中包含完整的红外(IR)光谱,不同的峰对应于不同的生物分子,同时还可以获得这些分子的空间信息,其中衰减全反射(AttenuatedTotal Reflection,ATR)FT-IR还具有高分辨成像的特点[28]。Andanson等[29]应用FT-IR成像技术,测量了12种液体样品的皮肤的渗透性,并比较相同条件下几种促渗剂的透皮过程,可帮助研究促渗剂的促透动力学与相关的分子机制。Kong等[30]使用 FT-IR成像测量化学成分以及空间结构随时间的变化,以表征猪皮作为人类皮肤模型的特征,证明了猪皮在光谱学上类似于人类皮肤,同时考察了猪皮透皮扩散能力和稳定性,结果表明,猪皮对药物透皮渗透的研究有很大的帮助。
4.2 拉曼光谱成像
分子对光的拉曼散射,是1923年Smekal通过经典量子理论预测的,并于1928年由Raman和Krishnan在实验中观察到。拉曼光谱的出现和发展对生物和医学领域产生了极大的影响,因为它是一种无标记且化学选择性高的光谱成像技术,对于透皮贴剂而言,可以使用拉曼光谱获取皮肤中待测物组成和浓度变化的详细信息并将其可视化,以显示待测物在皮肤中的空间分布[31]。目前常用的拉曼技术主要有相干反斯托克斯拉曼散射(CoherentAnti-Stokes Raman Scattering,CARS)、表面增强拉曼散射(Surface-enhanced Raman Scattering,S E R S ) 、 受 激 拉 曼 散 射 ( S t i m u l a t e d R a m a nScattering,SRS)。
CARS显微镜是一种基于拉曼散射的无标记化学成像方法,它可以利用化学键的拉曼振动频率产生对比度图像,与传统的拉曼信号相比,CARS的高对比度图像具有明显的优势,CARS是一个三阶非线性四波混频过程,由2个脉冲激光组成,2个不同波长的脉冲激光与样品相互作用,在反斯托克斯频率下产生分子的相干激发,产生的信号通常是自发拉曼散射的106倍,但会出现与拉曼位移无关的非共振背景对测定结果造成干扰[32]。
传统拉曼光谱的主要缺陷是拉曼散射信号非常弱,可能无法检测到低浓度的分子,从而限制了拉曼光谱的发展,SERS是一种可将拉曼信号增强几个数量级的拉曼光谱技术,将分析物放置在相对粗糙的金属表面(最常用的金属材料是金和银)即可实现,SERS增强拉曼信号的机制主要是电磁场增强以及通过金属表面和分析物之间的电荷转移进行化学增强[33]。
SRS是一个相干四波非线性光学混频过程,可提供比自发拉曼光谱更强的信号,SRS过程取决于泵浦光束和斯托克斯光束,通常是将调谐到斯托克斯频率的外部辐射源与泵浦光束串联来激发这种效应,并且可通过泵浦辐射的能量增强斯托克斯信号,使其快速填充最终振动态[34]。Ito等[35]提出了一种新的成像方法——相位调制 SRS(PM-SRS),具有定量测量能力和高灵敏度,使用相位调制和时间分辨检测来去除背景信号,他们分别使用PMSRS与调幅SRS(AM-SRS)两种SRS模式对四氢嘧啶进行了体外渗透试验,通过PM-SRS模式获得的光谱具有接近零水平的背景信号基线并且PM-SRS信号与四氢嘧啶浓度成正比。
4.3 质谱成像
质谱成像(Mass Spectrometry Imaging,MSI)技术起源于20世纪70年代,具有高特异性和高灵敏度,在过去的几十年里得到了迅速发展,MSI可用于观察内源性和外源性化合物的分布,包括脂类、蛋白质、药物和代谢物,而不需要使用荧光标记或放射性标记化合物。MSI的主要技术包括二次离子质谱(Secondary-ion Mass Spectrometry,SIMS)、基质辅助激光解吸电离(Matrix-assistedLaser Desorption Ionization,MALDI)、解吸电喷雾电离(Desorption Electrospray Ionization,DESI)、液体萃取表面分析(Liquid Extraction SurfaceAnalysis,LESA)、激光消融电喷雾电离(LaserAblation Electrospray Ionization,LAESI)、激光解吸电离(Laser Desorption Postionization,LDPI)和飞秒激光解吸电离(Femtosecond Laser DesorptionPostionization,fs-LDPI),其中MALDI-MSI被广泛应用于透皮研究中,可对全身或不同器官动物切片的各种药物的空间分布进行分析。
MALDI-MSI是一种基于激光照射从表面解吸和电离待测物,然后对电离分子进行质谱分析,以获得目标化合物的空间分布图像的技术[36]。MALDI-MSI已成为无标记生物分析的关键技术,可以对生物分子、药物和其他外来物质在组织切片中的空间分布进行分析,在应用MALDI-MSI分析时,待测物电离的性质很大程度上取决于待测物和组织的实体,同一分子在不同组织中或在同一组织中可能会受到不同的离子抑制效应从而引起离子信号的变化,这可能是开发MALDI-MSI作为定量质谱成像(Quantitative Mass SpectrometryImaging,QMSI)方法时需要解决的主要问题[37]。应用MALDI-MSI进行定量分析需要考虑多方面的影响,因为任何基于MS的分析,待测物的强度都会同时受到几个因素的影响,包括待测物的提取效率、电离效率和其与基质共结晶的一致性,此外,离子抑制也是MALDI-MSI定量分析的一个重要因素[38]。
MALDI-MSI是一种能够同时检测多种化合物的成像技术,应用非常广泛,据报道[39]已成功地应用于分析药物在猪皮的空间分布情况,同时可以比较作用于局部的药物的渗透能力。当MALDI-MSI应用于透皮贴剂时,皮肤作为定量试验的靶器官,组织成分对MSI信号响应的影响具有重要意义。在透皮贴剂的研究中,可将Franz扩散池与MALDIMSI技术结合来对渗透行为进行分析,增加对皮肤、辅料和药物分子之间复杂相互作用的理解,从而对透皮贴剂的体外渗透与体内分布作出更加科学和全面的分析。Handler等[40]应用Franz扩散池法对3种处方的托法替尼进行了体外渗透试验,并用MALDI-MSI定量测定药物在皮肤中的渗透性,为了解托法替尼在皮肤中的分布提供了有价值的信息。
5、总结与展望
透皮贴剂的渗透性研究主要包括如何改善透皮贴剂中药物的渗透性以及如何评价透皮贴剂体外渗透性。改善透皮贴剂中药物的渗透性,提高其生物利用度,这就需要我们对各种促透方法的机制有一个全面而深入的了解,在此基础上开发两种或几种促透方法的联用技术,扬长避短,寻找最为适合的促透方法。而如何评价透皮贴剂体外渗透性,例如进行渗透试验时皮肤模型的选择、体外渗透结果的分析等,就需要相关部门加大研发水平,完善相应的标准和要求。