2022年全年披露的医疗器械不良事件报告来源中,共有2017476起来源于制造商主动上报,比例高达97.77%。
2022年,澳大利亚的 医疗器械不良事件报告来源主要为制造商和供应商,上报数量为5297起,占90.83%。
近两年美国医疗器械不良事件高发的产品类型多为糖尿病治疗相关产品,可能与糖尿病患者数量较多有关。同时,澳大利亚的不良事件高发产品类型也包含胰岛素泵等糖尿病治疗相关产品。
医疗器械不良事件是指,已上市的医疗器械在正常使用情况下发生的导致或者可能导致人体伤害的各种有害事件。不良事件数据是医疗器械上市后监管的重要数据源之一,目前,全球很多国家和地区都建立了医疗器械不良事件上报制度及不良事件数据库。
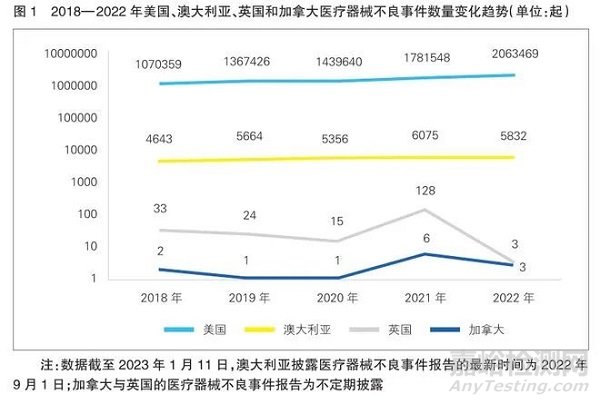
MDCLOUD(医械数据云)统计了2018年至2022年,美国、澳大利亚、英国和加拿大的医疗器械不良事件数据(详见图1)。其中,美国报告的不良事件数呈逐年上升趋势,由1070359起增至2063469起;澳大利亚报告的不良事件数量呈波动上升趋势,由2018年的4643起增至2021年的6075起,在2022年下降至5832起;英国的不良事件报告披露较少,在2018年至2020年呈下降的趋势,在2021年突增至128起,又在2022年剧减至3起;加拿大报告的不良事件数量在近五年维持在个位数以内,2019年和2020年最低,均只有1起,2021年最高,为6起。
一、医疗器械不良事件整体情况
1、美国
2022年医疗器械不良事件数同比增长15.8%
据MDCLOUD统计,2022年美国医疗器械不良事件数据库(以下简称MAUDE数据库)共披露2063469起不良事件,对比2021年的1781548起,增加了281921起。其中,6月份达到全年单月不良事件数峰值,共有217803起。
致伤/致死事件占比较往年同期下降
MAUDE数据库将不良事件的事件类型界定为:故障、致伤、致死、无解释和其他,另有少量事件没有划分。统计显示,2022年美国医疗器械不良事件占比最高的事件类型为故障事件,达69.61%,共发生1436248起;其次为致伤事件,共有617132起,占总数的29.91%;致死事件共发生了9841起,占0.48%;此外,还有71起不良事件为无解释及其他事件类型(有177起不良事件无相关信息,不列入统计)。2022年全年,致伤、致死事件数量单月变化相对较小。其中,10月份的致伤事件与致死事件最多,分别达到61275起和1048起;故障事件数量变化呈现波动,6月份达到全年单月最高,共168300起。
而2021年,美国医疗器械不良事件中故障事件1059188起,致伤事件712723起,致死事件9317起。对比得知,2022年美国医疗器械不良事件的故障事件类型比例增长了约10%,致伤事件和致死事件类型占比有所减少,分别下降了10.1%和0.04%。
超95%不良事件由制造商主动上报
2022年全年披露的医疗器械不良事件报告来源中,共有2017476起来源于制造商主动上报,比例高达97.77%。另有34251起来源于分销商,7341起为自愿上报,4401起来自用户设施,分别占比1.66%、0.36%、0.21%。相比2021年,由制造商上报的医疗器械不良事件有1662666起,占比93.33%,可以看出美国医疗器械不良事件的上报绝大多数来源于制造商,且2022年的上报数量和占比对比2021年都有所提升。
2、澳大利亚
整体医疗器械不良事件数量变化较平缓
据MDCLOUD(医械数据云)统计,截至2023年1月11日,澳大利亚2021年与2022年的医疗器械不良事件数分别为6075起和5832起。2022年3月份出现单月不良事件数峰值,为1145起,随后出现回落,但总体上每月不良事件数波动相对较小,整体情况较平缓。
致伤事件占比超7成
澳大利亚将医疗器械不良事件引发后果分为:致伤、致死和未致伤三类。数据显示,2022年共有3909起医疗器械不良事件引发致伤后果,占总事件数的70.78%;1556起未致伤,占28.17%;58起引发致死后果,占1.05%(有309份不良事件报告相关信息,不列入统计)。对比2021年相关数据,2022年引发致伤后果的事件比例提升了1.5%,引发致死后果的事件比例下降0.59%。
制造商和供应商主动上报比例超90%
2022年,澳大利亚的医疗器械不良事件报告来源主要为制造商和供应商,上报数量为5297起,占90.83%;267起来自消费者,占4.58%;135起为来自医疗专业人士,占2.31%;122起来自其他报告人,占2.09%;11起来自医学研究人员,占0.19%。对比2021年的报告来源类型占比,2022年的制造商和供应商上报、消费者上报比例有所提升,整体以制造商和供应商上报为主。
3、英国
2022年英国医疗器械署官网仅披露了3起医疗器械不良事件,相比2021年的128起,大幅减少。2022年披露的3起不良事件报告涉及的产品为阴道扩张器和妇科宫腔镜护套,紫杉醇药物涂层球囊与药物洗脱支架,以及血液透析机和血液滤过机。
4、加拿大
2022年加拿大共披露了3起医疗器械不良事件,相比2021年的6起有所减少。2022年披露的不良事件中涉及的产品有COVID-19快速抗原检测试剂盒、腹膜透析转移装置,以及臭氧桑拿相关的未经许可的设备等。
二、医疗器械不良事件涉及产品情况
由于美国和澳大利亚公开披露的医疗器械不良事件数据量相对较大,故而对这两个国家医疗器械不良事件涉及的产品类型及相关产品故障问题进行进一步统计分析。
1、美国
胰岛素泵相关产品不良事件超48万起
美国医疗器械产品分类代码对应的2022年不良事件数统计显示,2022年,报告医疗器械不良事件数量最多的单类产品为根管重塑牙内-骨内种植体(DZE),数量近27万起;其次为工厂校准式一体型连续血糖监控系统(QBJ)和输液泵(FRN)。位列不良事件数量前十的产品(详见图2)中,共有5类产品为胰岛素泵相关产品,分别为单激素控制自动胰岛素剂量泵(OZP)、备用控制器启用的胰岛素输注泵(QFG)、胰岛素泵(用于侵入性血糖传感器,OYC)、带阈值-暂停功能的自动胰岛素剂量泵(OZO)和胰岛素泵(LZG),共计报道了484180起。
值得关注的是,对比2021年医疗器械不良事件数量排名前十的产品类型,可以发现,DZE、QBJ和FRN一直位列前三。此外,5类胰岛素类产品(OZP、QFG、OYC、OZO、LZG)同样出现在2021年的不良事件数位列前十的产品类型中。
鉴于DZE、QBJ和FRN这三类产品的不良事件数量相对较多,故对这三类产品相关不良事件的设备问题和患者问题进行统计分析。
DZE 、 OBJ 、 FRN相关不良事件涉及的高频设备问题
对DZE相关不良事件涉及的设备问题进行数量统计,排在前五的高频设备问题分别为:骨整合失败(167356起)、骨整合丧失(63465起)、没有识别设备或使用问题的不良事件(14532起)、骨整合问题(8884起)和断裂(4952起)。提示该类产品的不良事件主要与种植体骨整合失败、减弱或是与骨组织连接出现问题相关。
对QBJ相关不良事件涉及的设备问题进行数量统计,排在前五的高频设备问题分别为:无线通信问题(128018起)、无设备输出(44846起)、不精确(25001起)、过早报废指示器(14187起)和意外的应用程序关闭(4753起)。提示该类产品的不良事件主要与设备的通信故障、信号输出、指示器寿命短等问题相关。
对FRN相关不良事件涉及的设备问题进行数量统计,排在前五的高频设备问题分别为:腐蚀(57840起)、显示难以阅读(31062起)、折断(29112起)、无法读取输入信号(14993起)和裂缝(11954起)。提示该类产品的不良事件主要与产品不耐腐蚀、易折断、破损等问题相关。
DZE 、 OBJ 、 FRN相关不良事件涉及的高频患者问题
经对DZE、QBJ和FRN相关不良事件涉及的患者问题进行数量统计,可以看到,三者涉及最高频的患者问题均为没有临床体征、症状或状况(分别为92496起、209286起和162935起),尤其是QBJ和FRN,说明这两类产品的不良事件大多数并未对患者造成伤害。而DZE相关不良事件中,种植体由于骨整合出现问题后会导致种植体周围纤维化,乃至植入失败,会造成患者出现疼痛等临床反应。
2、澳大利亚
体外诊断器械不良事件数增长明显
澳大利亚将器械产品分为:医疗器械(Ⅰ类、Ⅰm类、Ⅰs类、Ⅱa类、Ⅱb类、Ⅲ类)、体外诊断器械(1类、2类、3类、4类)和有源植入器械三类。据MDCLOUD统计,2022年澳大利亚的医疗器械类不良事件共有3211起,占76.74%;体外诊断器械类不良事件共567起,占13.55%;有源植入器械类不良事件406起,占9.70%(有1648份报告无产品分类信息,不列入统计)。对比2021年的不良事件,2022年医疗器械类和有源植入器械类的事件数量占比有所下降,体外诊断器械类的事件数量占比有所提升。
对三类器械的细分管理类别对应的不良事件数进行统计发现,无论是2021年还是2022年,Ⅲ类医疗器械的不良事件数量均最多,其次是Ⅱb类医疗器械。值得注意的是,相较2021年,2022年的3类体外诊断器械不良事件数量明显上升,从2021年的133起增长到2022年的520起。
2022年冠状病毒体外诊断试剂不良事件激增
2022年,澳大利亚不良事件数量排名前三的产品类别分别为严重急性呼吸综合征相关冠状病毒体外诊断试剂(462起)、 心脏内植入式起搏器导线(206起)、动态胰岛素输液泵(169起)。而在2021年,严重急性呼吸综合征相关冠状病毒体外诊断试剂的不良事件仅有26起,该产品的不良事件数在一年内增长了十几倍。
冠状病毒体外诊断试剂的高频事件故障类型
对2022年不良事件数量激增的严重急性呼吸综合征相关冠状病毒体外诊断试剂产品事件故障类型进行统计,可以看到高频的事件故障主要为:输出问题(239起)、制造(111起)、无适当的名称/代码(21起)、设备使用问题(15起)和标签(15起)。
三、对我国医疗器械行业的启示
1、加强对海外医疗器械不良事件的关注程度
得益于行业内的制造商对不良事件的主动上报,美国、澳大利亚的不良事件数据量相对较大,报告内容更规范,数据可用度相对较高,且数据量逐年增加。
针对特定产品,结合产品的不良事件类型、设备问题、患者问题等进行统计分析,可初步了解产品的安全性。国内医疗器械行业加强对海外尤其是美国和澳大利亚两国的医疗器械不良事件关注,将有助于产品的安全性评估与研发改进。
2、糖尿病治疗与监控产品需重点监测
目前,全球糖尿病患者人数已超3亿,2020年美国相关统计报告显示,全国糖尿病患者共3420万(包括2690万确诊患者和730万未确诊患者),占美国总人口的10.1%。近两年美国医疗器械不良事件高发的产品类型多为糖尿病治疗相关产品,可能与糖尿病患者数量较多有关。同时,澳大利亚的不良事件高发产品类型同样也包含胰岛素泵等糖尿病治疗相关产品。
据统计,我国糖尿病患者人数在2016年已达1亿,糖尿病治疗器械使用量更为庞大。对美国、澳大利亚的胰岛素泵、血糖监控系统的不良事件进行持续监测,可为我国糖尿病患者在使用同类产品时提供警示参考。
3、海外高风险产品不良事件值得分析借鉴
根据2021年和2022年美国、澳大利亚两国披露的相关数据分析可知,心脏内植入式起搏器导线、动态胰岛素输液泵和脊髓镇痛用电刺激器这三类产品在澳大利亚报告的不良事件数量较多;牙种植体、连续血糖监控系统和输液泵在美国报告的不良事件数量始终位列前三。
重点关注近两年海外高风险产品的国内同类产品的使用情况,并对海外重点高风险产品的故障问题和对患者的伤害表现进行分析,可在国内同类产品发生类似不良事件时,借鉴相关事件处置方案与故障问题分析经验。