今日头条
银诺长效GLP-1R激动剂获批NASH临床。银诺医药自主研发的人源化长效GLP-1R激动剂苏帕鲁肽(Supaglutide)获FDA临床许可,拟开展用于非酒精性脂肪性肝炎(NASH)的临床试验。2023年1月,银诺医药宣布苏帕鲁肽用于治疗2型糖尿病的两项Ⅲ期临床(YN011-301、YN011-302)均达到主要终点,糖化血红蛋白相对基线降低可达2.1%,显著优于安慰剂组(P<0.001), 且安全性和耐受性良好。
国内药讯
1.迈威nectin-4-ADC实体瘤II期临床积极。迈威生物Nectin-4-ADC创新药9MW2821在治疗实体瘤的II期临床获积极结果。在推荐剂量(RP2D)下,9MW2821在尿路上皮癌患者中的客观缓解率(ORR)达50%,疾病控制率(DCR)达到100%;在宫颈癌患者中的ORR达50%,DCR达100%;药物的总体安全性良好。该公司正积极推进尿路上皮癌、宫颈癌、前列腺癌、HER-2阴性乳腺癌、非小细胞肺癌等多个队列扩展入组。
2.融捷康IL-4Rα/5纳米双抗在美获批临床。融捷康生物自主研发的双特异性纳米抗体RC1416(重组抗人IL-4Rα和IL-5单域抗体注射液 )获FDA临床许可。IL-4Rα靶向药可同时阻断IL-4与IL-13两条通路,能够显著抑制炎症性Th2细胞,以及下游的参与炎症反应的嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞的活性。今年3月,该新药已在国内获批可开展用于中重度哮喘附加维持治疗的临床研究。
3.德昇济两款抗肿瘤新药获批临床。德昇济医药开发的小分子ERK1/2抑制剂D3S-002和HER2/CD47双抗D3L-001同期获得FDA的IND批准。在临床前研究中,D3S-002与KRAS G12C小分子抑制剂D3S-001联用可增强在肺癌及结肠癌中的药效以及持续时间,并有潜力克服经KRAS G12C抑制剂治疗后产生的继发突变。D3L-001通过HER2优先与肿瘤细胞结合,以减少CD47靶点潜在的血液毒性,并能使抗体依赖的细胞毒性作用(ADCC)和细胞吞噬作用(ADCP)协同发挥最大作用。
4.和泽第2款GLP-1R/GIPR激动剂获批临床。和泽医药1类化药P29注射液获国家药监局临床许可,拟开展2型糖尿病患者的血糖控制的I期临床研究。P29是该公司第二款GLP-1R/GIPR双重激动剂,拟开发每周1次用于成人2型糖尿病患者的血糖控制和减重适应症。2022年10月,和泽医药的第一款GLP-1R/GIPR激动剂HZ010注射液已正式启动I期临床,评估用于2型糖尿病患者的血糖控制的安全性和耐受性研究。
5.药明巨诺CD19-CAR-T获批SLE临床。药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(商品名:倍诺达)获国家药监局批准一项新的临床试验默示许可,针对的适应症为中重度难治性系统性红斑狼疮(SLE)。研究表明,CD19 CAR-T治疗不仅能有效地消除产生自身免疫抗体的B细胞,而且还能让SLE患者实现无治疗缓解,治疗效果即使在患者体内B细胞重建后仍然持续存在。
国际药讯
1.辉瑞双价RSV疫苗Ⅲ期成果见刊NEJM。辉瑞重组RSV融合前F蛋白双价疫苗RSVpreF(PF-06928316)在《新英格兰医学杂志》公布用于保护老年人与婴孩避免感染呼吸道合胞病毒(RSV)相关下呼吸道疾病的两项Ⅲ期试验积极结果。在RENOIR临床中,疫苗在预防至少有两种症状的RSV相关下呼吸道疾病方面的有效率达到66.7%(96.66% CI:28.8-85.8);在MATISSE试验中,疫苗避免婴孩出生后90天内感染需要医疗护理的RSV相关下呼吸道疾病的有效率达(99.5% CI:40.6-96.3)。
2.Akebia公司肾性贫血新药最新临床积极。Akebia公司口服HIF-PHI疗法vadadustat治疗血液透析贫血患者的FO2CUS研究达到主要和次要终点。与红细胞生成刺激剂(ESA)相比,vadadustat(600mg、900mg)治疗组患者的血红蛋白(Hb)水平较基线的变化方面达到非劣效标准(非劣效性界值为0.75g/dL),患者Hb的最小二乘均值差异为-0.33g/dL(-0.53,-0.13)。两组患者不良反应(TEAE)发生率分别为78.7%和75.3%。
3.礼来口服GLP-1R激动剂上III期临床。礼来与中外制药合作开发的非肽类口服GLP-1R激动剂LY3502970(Orforglipron)在clinicaltrials.gov网站上登记启动一项III期临床(ACHIEVE-4),拟评估LY3502970(递增剂量,每日1次)对比甘精胰岛素(个性化剂量,每日1次)在心血管风险增加的2型糖尿病患者和肥胖或超重患者中的安全性和有效性。在中国,CDE已于3月22日受理该新药的1类化药临床试验申请。
4.安进CDH3/MSLN双抗上I期临床。安进基于其专有BiTE分子技术平台开发的CDH3/MSLN双抗AMG 305在clinicaltrials.gov网站上登记启动一项I期临床试验,拟评估用于治疗晚期实体瘤患者的的安全性、耐受性和药代动力学特征,以及初步疗效。该项研究将入组由TCGA(癌症基因组图谱计划)数据库mRNA确认、具有组织学或细胞学水平表达的CDH3和MSLN的260例实体瘤受试者,预计于2023年6月开始,并于2026年10月完成。
5.Cabaletta公司CAR T疗法获批自免病临床。baletta Bio公司基于驯鹿生物全人源CD19序列开发的CAR-T候选产品CABA-201获FDA临床许可,拟启动Ⅰ/Ⅱ期临床试验,评估用于治疗活动性狼疮肾炎(LN)或无肾脏受累的活动性系统性红斑狼疮(SLE)的安全性与有效性。去年10月,驯鹿生物授权该公司CD19序列开发自免疗法,驯鹿生物将拥有合作产品在大中华区开发和商品化的优先权。
6.艾伯维/强生计划撤回伊布替尼两项适应症。艾伯维与强生联合宣布,计划在美国自愿撤回BTK抑制剂伊布替尼(Imbruvica)的两项加速批准上市许可,用于既往接受过至少一种治疗的套细胞淋巴瘤(MCL)患者,以及既往接受过至少一种抗CD20治疗的边缘区淋巴瘤(MZL)患者。Imbruvica在针对MCL初治患者的验证性III期SHINE(NCT01776840)研究中达到无进展生存期(PFS)的主要终点,但未能显著改善患者的总生存期。在III期SELENE研究(NCT01974440)中,该药亦未能显著改善MZL患者的PFS。
医药热点
1.常州二院医美中心、医美损伤救治康复中心成立。为有效推动常州地区医疗美容技术水平,常州市第二人民医院日前在阳湖院区正式成立医学美容中心、医美损伤救治康复中心、上海九院整形外科专家团队工作室。医学美容中心主要服务包括整形手术类项目(微整形、眼整形、鼻整形、面部轮廓、面部抗衰、乳房整形、形体雕塑、疤痕治疗等)、光电类项目(光子嫩肤、超光子、黄金微针、冰点脱毛、去痣等)和注射类项目(水光注射、玻尿酸注射、肉毒素注射等)。
2.上海儿童医学中心贵州医院揭牌。4月6日,国家区域医疗中心上海儿童医学中心贵州医院揭牌暨贵州省人民医院观山湖院区开诊仪式在贵阳举行。上海儿童医学中心贵州医院揭牌暨贵州省人民医院观山湖院区开诊后,总业务用房近36.9万平方米,预计将开设床位3055张,其中上海儿童医学中心贵州医院开设床位697张,省医观山湖院区开设床位2358张。计划开设重症监护室床位共241张。设住院手术室总计53间,含杂交手术室3间,门诊手术室5间。
3.徐浩新教授加盟浙江大学医学院。4月7日,浙江大学医学院徐浩新求是讲席教授入职欢迎仪式在紫金港校区举行。2022年底,徐浩新正式辞去美国密歇根大学教授之职,回国全职加盟良渚实验室,任浙江大学求是讲席教授,并同时担任浙江大学基础医学院院长。加盟良渚实验室后,徐浩新团队将继续开展溶酶体离子通道的相关工作,同时也将研究拓展到其它细胞器,并在已发现的另外7个离子通道上展开转化研究。
评审动态
1. CDE新药受理情况(04月09日)
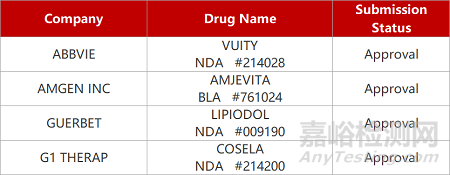
2. FDA新药获批情况(北美04月06日)