您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-04-21 08:13
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
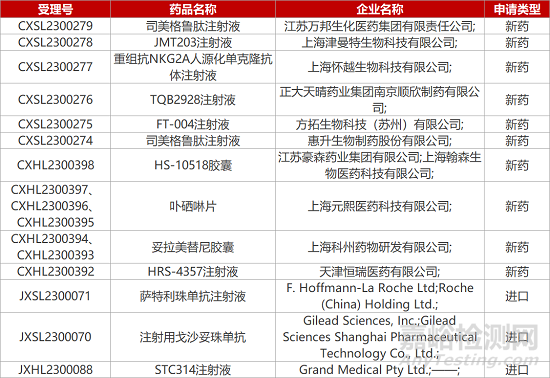
1.琅钰替洛利生完成OSA临床中国队列入组。琅钰集团旗下琅铧医药在中国开展的H3受体拮抗剂/反向激动剂替洛利生治疗阻塞性睡眠呼吸暂停(OSA)的III期临床完成全部240例患者入组。该项目牵头研究者为中国医师协会睡眠医学专业委员会主任委员、清华大学附属北京清华长庚医院叶京英教授。盐酸替洛利生薄膜衣片有望成为国内首个改善OSA日间过度嗜睡症状的非精神管控药物。
2.信达/劲方KRAS-G12C抑制剂早期临床积极。信达生物与劲方医药合作开发的KRASG12C抑制剂IBI351在AACR2023年会上公布单药治疗晚期实体瘤患者的Ⅰ期临床积极结果。在67例非小细胞肺癌疗效可评估人群中,客观缓解率(ORR)为61.2%,疾病控制率(DCR)为92.5%。药物总体耐受性良好,各剂量组未观察到剂量限制性毒性(DLT)事件,最大耐受量(MTD)未达到。共有94.0%患者发生药物相关不良事件(TRAEs),大部分为1-2级。
3.中盛溯源iPSC来源NK细胞获批临床。 安徽中盛溯源基于CMC技术平台开发的基因修饰iNK产品“NCR300注射液”获国家药监局临床许可,拟开展针对骨髓增生异常综合征(MDS)的临床试验。这是国内首个获批临床的iPSC来源的自然杀伤细胞(iNK)疗法。目前,全球范围内仅有Fate Therapeutics、Century Therapeutics公司iPSC来源的NK细胞疗法进入临床试验阶段。
4.科济CLDN18.2靶向CAR-T获批新临床。上海科济制药1类生物制品“CT041自体CAR T细胞注射液”新适应症临床试验申请获国家药监局默示许可,拟开发用于CLDN18.2表达阳性的胰腺癌患者术后辅助治疗。CT041是一款CLDN18.2靶向自体CAR-T细胞产品,正在II期临床中评估用于晚期胃癌/食管胃结合部腺癌的治疗潜力。此前该新药已分别获FDA和EMA授予的孤儿药资格,EMA授予的优先药物资格,以及FDA授予的再生医学先进疗法资格。
5.苏州方拓血友病B基因疗法报IND。方拓生物1类生物制品“FT-004注射液”的临床试验申请获CDE受理,针对的适应症为血友病B(内源性FIX活性≤2%)。FT-004注射液是一款新型重组腺相关病毒载体基因治疗药物。非临床数据显示,FT-004注射后可高效转染肝细胞,使其持续、稳定地表达和分泌具有活性的hFIX(人凝血因子9)蛋白,提高凝血功能。
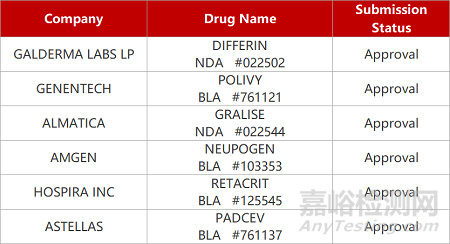
1.罗氏CD79b-ADC获批一线治疗DLBCL。罗氏旗下公司基因泰克CD79b-ADC药物Polivy(polatuzumab vedotin)获FDA批准新适应症,与利妥昔单抗加环磷酰胺、多柔比星和泼尼松(R-CHP)联用,一线治疗弥漫性大B细胞淋巴瘤(DLBCL)患者。在Ⅲ期临床POLARIX中,与标准治疗相比,Polivy+R-CHP组的疾病进展、复发或死亡风险降低27%。FDA同时将Polivy与苯达莫司汀和利妥昔单抗联用,治疗接受过至少两种前期疗法的复发/难治性DLBCL的加速批准转化为完全批准。
2.Ardelyx公司磷酸盐抑制剂重新报NDA。Ardelyx公司磷酸盐抑制剂tenapanor(Xphozah)重新向FDA提交新药上市申请,用于治疗接受透析的对磷酸盐结合剂治疗反应不足或不耐受的成年慢性肾病(CKD)患者的高磷血症。在BLOCK研究中,Xphozah组3mg、10mg和30mg剂量组患者的血清磷水平分别平均降低1.00mg/dL、1.02mg/dL和1.19mg/dL;在随机戒断期,Xphozah组患者的血清磷水平相比安慰剂组也未明显反弹。
3.HPV疫苗联用PD-L1单抗宫颈癌II期临床积极。Nykode Therapeutics ASA公司肿瘤疫苗VB10.16与PD-L1抑制剂atezolizumab联用治疗晚期或复发性、不可切除的HPV16阳性宫颈癌II期VB-C-02试验结果积极。结果显示,PD-L1阳性患者的中位无进展生存期(mPFS)为16.9个月,ORR为40%,DCR为80%,中位总生存期(mOS)还未成熟(>25个月);总人群mOS为16.9个月,mPFS为4.1个月,ORR为19%,DCR为60%。此外,联合治疗的耐受性良好。
4.PD-L1抗体+VEGFR抑制剂治疗STS临床积极。诺华制药VEGFR抑制剂帕唑帕尼(pazopanib)在AACR2023年会上公布联合PD-L1抗体度伐利尤单抗治疗此前接受过最多两组全身抗癌治疗的转移/复发软组织肉瘤(STS)患者的Ⅱ期临床积极结果。在46例可评估患者中,联合治疗达到30.5%的客观缓解;在中位随访18.4个月期间,中位无进展生存期(PFS)为7.7个月。在探索性分析中,B谱系特征是总体缓解的重要关键决定因素。
5.CD200R1抗体抗癌早期临床积极。23andMe公司靶向CD200R1的抗体药物23ME-00610在治疗肿瘤患者的Ⅰ/Ⅱa期临床试验中结果积极。Ⅰ期部分数据显示,在抗体剂量60毫克及以上观察到与CD200R1靶点饱和结合;23ME-00610的药代动力学呈剂量比例关系,1400毫克时的中位终末半衰期约为12天,支持每三周给予23ME-00610一次。未观察到剂量限制性毒性,大多数人至少出现1次与治疗相关的不良事件(TRAE),其中大部分为1级或2级。

来源:药研发