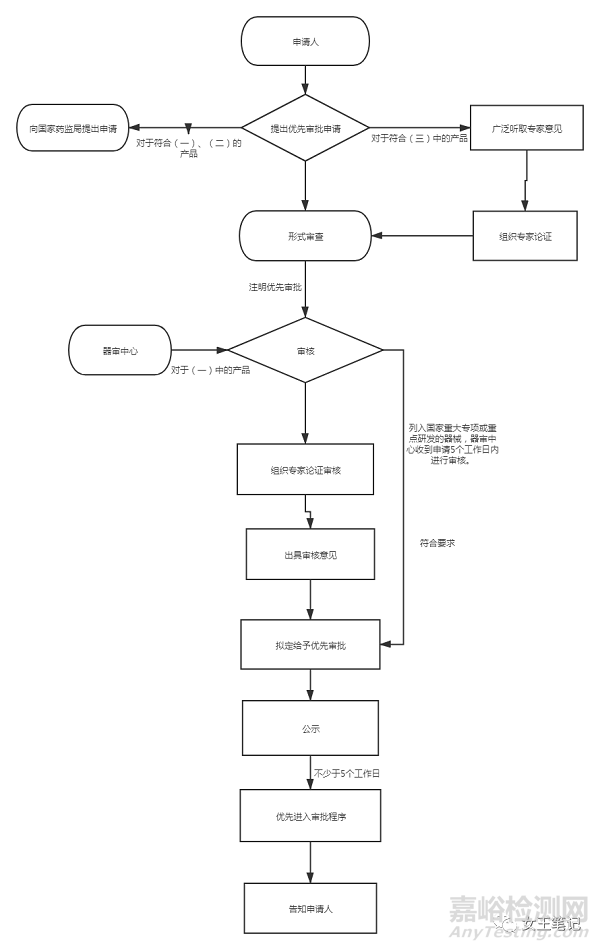
《医疗器械优先审批程序》与创新医疗器械特别审批程序并行运行,申请人可以根据产品具体情况选择合适的程序进行申请。已经按照《医疗器械应急审批程序》、《创新医疗器械特备审批程序》进行审批的注册申请项目,不执行本程序。
优先审批的条件
符合下列条件之一的境内第三类和进口第二类、第三类医疗器械注册申请实施优先审批:
(一)符合下列情形之一的医疗器械:
1、诊断或治疗罕见病,且具有明显的临床优势;
2、诊断或治疗恶性肿瘤,且具有明显的临床优势;
3、诊断或治疗老年人特有疾病和多发疾病,且目前尚无有效诊断或者治疗手段;
4、专用于儿童,且具有明显的临床优势;
5、临床急需,且在我国尚无同品种产品获准注册的医疗器械;
(二)列入国家科技重大专项或者国家重点研发计划的医疗器械;(申报注册时需要提交该产品列入国家科技重大专项或者国家重点研发计划的相关证明文件)
(三)其他应当优先审批的医疗器械。(对于其他应当优先审批的医疗器械,由国家药监局广泛听取意见,并组织专家论证后再确定是否予以优先审批)
优先审批流程
优先审批的优势
1、器审中心对于优先审核的项目,按照接收时间单独排序,优先进行技术审评。
2、省药监局优先进行体系核查
3、专项交流
优先审批申请资料编写
《优先审批申请表》
|
产品名称
|
|
|
申请人
|
|
|
受理号
|
(受理后由受理部门填写)
|
|
联系人
|
|
联系方式
|
|
|
优先审批理由
|
明确说明产品适用于《医疗器械优先审批程序》中规定的何种情形,简述优先审批的理由。
注:说明该项目优先审批的理由,相关依据可作为附件一并提交。
|
|
备注
|
|
|
申请人签章
|
签章是指:企业盖章、或其法定代表人、负责人签名加盖企业盖章。
进口器械签章:原文资料均应由申请人签章,中文资料由代理人签章。(原文资料的签章:申请人的法定代表人或者负责人签名,或者签名加盖组织机构印章,并提交由申请人所在地公证机构出具的公证件;)
提交中文资料,原文为外文的,翻译为中文,提交外文原件。
年 月 日
注:境内申请人由申请人签章,境外申请人由申请人或者其代理人签章。
|
(一)符合《医疗器械优先审批程序》情形的,应当提交一下资料:
1、诊断或者治疗罕见疾病,且具有明显临床优势:
(1)该产品的适应症的发病率数据及相关支持性资料;
(2)证明该适应症属于罕见病的支持性资料;
(3)该适应症的临床治疗现状综述;
(4)该产品较现有产品或治疗手段具有明显临床优势说明及相关支持性资料。
2、诊断或治疗恶性肿瘤,且具有明显临床优势:
(1)该产品适应症属于恶性肿瘤的支持性资料;
(2)该适应症的临床治疗现状综述;
(3)该产品较现有的产品或治疗手段具有明显临床优势说明及相关支持性资料。
3、诊断或治疗老年人特有和多发疾病,且目前尚无有效诊断或者治疗手段:
(1)干产品适应症属于老年人特有和多发疾病的支持性资料;
(2)该适应症的临床治疗现状综述;
(3)目前尚无有效诊断或治疗手段的说明及相关支持性资料。
4、专用于儿童,且具有明显的临床优势:
(1)该产品适应症属于儿童疾病的支持性资料
(2)该适应症的临床治疗现状综述
(3)证明该产品专用于诊断或者治疗儿童疾病,较现有产品和治疗手段具有明显临床优势说明及相关支持性资料;
5、临床急需,且在我国尚无同品种产品获准注册的医疗器械:
(1)该产品的适应症的临床治疗现状综述,说明临床急需的理由;
(2)该产品和同类产品在境外批准和临床使用情况;
(3)提供检索情况说明,证明目前国内无相关同品种产品获批注册,且目前尚无同等替代诊断或治疗方法。
6、所提交资料真实性的自我保证声明:
境内产品境内申请人出具;进口产品由产品申请人和代理人分别出具。
7、该产品列入国家科技重大专项或者国家重点研发计划的医疗器械说明,及相关支持性资料。
罕见病防治医疗器械的注册指导原则
一、适用范围:
本指导原则所指的罕见病,是指国家卫生健康委员会、科学技术部、工业和信息化部、国家药监总局、国家中医药管理局联合公布的罕见病目录中所包含的疾病。
二、罕见病免于进行临床试验的原则
1、针对用于罕见病治疗的医疗器械,其临床前经过充分的研究或有其他证据能够确定患者使用该器械的受益显著大于风险,企业在与技术审评部门沟通的前提下,根据技术审评部门的意见,可免于进行临床试验。
2、针对已有的同类产品上市的医疗器械(不包含体外诊断试剂),可采用同品种对比的方式对其临床应用的安全性和有效性进行评价。
3、这怒地境外已上市的用于罕见病防治的医疗器械,其境外的临床试验数据如满足《接受医疗器械境外临床试验数据技术指导原则》,可在注册时作为临床试验资料申报,如技术审评过程中审评部门认为产品上市前无需再补充境内临床试验的,可免于进行临床试验。
三、什么情况下需要做临床试验
用于罕见病防治的医疗器械,如其临床前的研究不能证明该产品临床应用患者受益受益显著大于风险,应进行临床试验。
1、临床前的研究资料包括哪些
(1)针对申报产品所防治的罕见病提供详细的研究背景资料,包括疾病的发病原因、临床症状、流行病学特征及该罕见病相关诊断及有效的治疗方法,明确现有方法临床应用的优缺点。该研究资料可以是申请人的科学研究结果或相关文献资料的总结。
(2)充分阐述申报产品的作用机理,明确申报产品使用时潜在的风险,并进行充分的临床前评估,产品在临床前研究应该能够确认产品风险在可接受范围内。
(3)提供申报产品详细的研究资料,在产品性能研究过程中建议采用模拟试验,以验证产品在模拟条件下使用的性能,同时论证模拟参数的合理性。如有必要应开展相应的细胞试验及动物试验。产品研究资料应能够证明产品的可能有效性。产品的研究资料应能够证明产品的可能有效性。
(4)提供申报产品与现有诊断或治疗方法(如有)和已上市同类产品(如有)充分的比较研究资料,并明确申报产品优势与患者受益情况。
三、临床试验机构规定
申请人应根据疾病流行病学特征、发病原因、发病年龄及相关诊疗手段等选择多家医疗器械临床试验机构进行临床试验。所选临床试验机构应在该疾病诊断或治疗方面具有明显优势。
四、临床试验的要求
1、临床试验应重点关注受试者的受益情况,同时,对产品临床应用安全性进行评估,所需罕见病病例数量可酌情减少。
2、用于罕见病诊断的医疗器械其适用人群除罕见病患者还包括疑似罕见病患者、正常人等人群,应考虑此部分人群的风险受益,并进行充分的临床验证。
3、用于治疗罕见病的医疗器械
针对目前尚无有效治疗手段的罕见病,申报产品在临床试验中应明确治疗效果的判定标准及制定依据;针对目前已有有效治疗手段的罕见病,申报产品在临床试验过程中可采用与已有治疗手段对比研究,已有治疗手段的有效性和患者风险受益比可汇总自临床历史研究数据。
4、用于诊断罕见病的医疗器械
(1)用于罕见病诊断或辅助诊断的产品,临床试验主要评价指标为临床灵敏度、临床特异性等,临床试验中选择对比方法可为该疾病公认的诊断标准或已上市的同类产品,必要时应对诊断结果进行跟踪随访。
(2)用于罕见病筛查的产品,应依据产品设定合理的临床评价和指标。临床试验中用于确认筛查结果的方法应为临床公认诊断标准。如有必要,筛查结果应有跟踪随访或其他方法确认。
五、临床试验病例
1、用于治疗罕见病的医疗器械
病例数可不满足统计学要求,但研究者应明确病例数确定的合理依据。
2、用于诊断罕见病的医疗器械
(1)针对适用范围为罕见病诊断或辅助诊断的产品,临床试验应根据产品临床特异性确定临床试验中需要入组的阴性病例数量,阴性病例应重点考虑对该疾病诊断可能存在干扰的病例。
同时,临床试验应依据疾病流行病学特征、临床试验机构条件等因素确定阳性病例数量。阳性病例可包含部分已确诊的病例,进行回顾性研究。阳性病例数可不满足统计学的要求,但研究者应明确阳性病例数量确定的合理依据。
(2)针对适用范围为罕见病筛查的产品,临床试验入组人群应为该产品目标适用人群,如正常人群或高风险人群,临床试验方案应依据疾病率确定受试者的数量,应保证临床试验过程中至少有真阳性病例筛出。此外,临床试验可包含部分已确诊的病例,进行回顾性研究,已补充评价产品临床检测性能。
六、批准上市(可附带条件批准上市)
1、限定可合法使用该产品的医疗机构范围;
2、明确该产品临床应用过程中的风险受益评估需重点关注的内容,以及患者需知情同意的内容;
3、产品上市后需进行的研究,例如:对该产品临床试验中入组的病例的后续研究及产品上市后临床使用情况等;
4、设定上市后产品的评价时限。
七、其他
产品延续注册时,对于未完成上市后产品评价的,在注册人提供合理解释的前提下,可准予延续,同时修改注册证中附带批准的条件,申请人应继续产品评价工作。