今日头条
圣诺抗凝血小核酸新药上I期临床。圣诺医药基于其专有GalAhead™技术开发的首款GalNAc-siRNA治疗药物STP122G在健康受试者中开展的Ⅰ期临床试验完成首例受试者给药。GalAhead™依托于独特的RNA结构,可以“沉默”单个或多个mRNA靶点。STP122G旨在通过靶向肝细胞产生的酶(因子XI),用以治疗抗凝血,如心房颤动、肺栓塞、深层静脉血栓(DVT)及预防因手术而导致的深层静脉血栓。
国内药讯
1.杨森乌司奴单抗中国获批用于儿童。强生旗下杨森IL-12/IL-23双靶向抑制剂乌司奴单抗注射液(喜达诺)获国家药监局批准新适应症,用于治疗6岁及以上儿童和青少年中重度斑块状银屑病患者。在Ⅲ期临床CADMUS Junior中,有77%患儿在接受Stelara治疗12周后皮肤斑块得到明显改善或者消失;有84%和64%患儿的银屑病面积和严重性指数(PASI)得分提高75%或90%。此前,该药已获批用于治疗成人中重度斑块状银屑病。
2.康宁杰瑞免疫疗法组合Ⅱ期临床积极。康宁杰瑞在ASCO2023年会上公布HER2双抗KN026联合PD-L1/CTLA-4双抗KN046的无化疗方案治疗HER2阳性恶性实体瘤的Ⅱ期研究(KN026-203)更新数据。在26例可评估患者中,KN026与KN046联合治疗的客观缓解率(ORR)达到53.3% (95% CI: 26.6, 78.7),中位缓解持续时间(DOR)为6.8个月(95% CI: 2.9, 15.3),中位无进展生存时间(PFS)为5.6个月(95% CI: 2.9, 16.5),12个月生存率为80.4% (95% CI: 59.1, 91.4)。无治疗相关的死亡事件发生。
3.百济神州HER2双抗胆道癌Ⅱb期临床积极。百济神州在ASCO2023年会上公布HER2双抗泽尼达妥单抗治疗既往经治的HER2扩增性胆道癌的关键Ⅱb期HERIZON-BTC-01研究积极结果。在HER2阳性患者中,经独立中心审查(ICR)确认的客观缓解率(cORR)为41%。中位反应持续时间(DOR)为12.9个月;中位研究随访时间为12.4个月。治疗相关不良事件(TRAE)发生率为72%,3级TRAEs发生率为18%。
4.驯鹿/信达BCMA-CAR-T早期临床积极。驯鹿生物与信达生物联合开发的BCMA-CAR-T伊基奥仑赛注射液(CT103A;IBI326)在2023ASCO年会上公布治疗复发/难治性多发性骨髓瘤(RRMM)患者最新Ⅰ/Ⅱ期注册临床积极结果。中位随访为13.8个月时,总体缓解率(ORR)为 96.0%,其中严格意义的完全缓解/完全缓解率(sCR/CR)从之前68.4%增加到74.3%。12个月的PFS率为78.8%(95% CI: 68.6–85.97)。95.0%(96/101)的受试者达到微小残留病灶(MRD)阴性。
5.诗健Trop 2靶向ADC早期临床积极。诗健生物靶向Trop2的ADC药物ESG401在ASCO2023年会上公布其针对晚期或转移性实体瘤的首次人体研究初步疗效数据。在33例可评估受试者中,ESG401达到36.4%的客观缓解率(ORR),疾病控制率(DCR)为63.6%;在三阴性乳腺癌(TNBC)患者中ORR为36.3%,DCR为63.6%;在HR+/HER2-乳腺癌患者中的ORR为61.5%,DCR为76.9%。与研究药物相关的不良事件(TRAEs)发生率为94.3%,3级及以上TRAEs发生率为34.3%。
6.恒瑞FIC前列腺癌新药获批临床。恒瑞医药及其子公司成都盛迪医药联合申报的1类化药HRS-5041片获国家药监局临床试验默示许可,即将开展用于治疗前列腺癌的临床研究。与二代AR抑制剂相比,HRS-5041片有克服耐药的潜力,目前国内外暂无同类药物获批上市。据悉,恒瑞医药在HRS-5041相关项目上累计已投入研发费用约2963万元。
7.翰森引进EGFR/cMet双抗获批实体瘤临床。翰森制药宣布该公司从普米斯生物引进的PM1080新药项目已获得国家药监局临床试验默示许可,即将开展用于治疗晚期实体瘤的临床研究。PM1080 (HS-20117)是一种EGFR/cMet双特异性抗体药物,具有能够同时阻断EGFR和c-Met 的信号传导,抑制肿瘤生长和存活等作用的治疗潜力。翰森制药拥有PM1080在中国的开发、注册审批、生产及商业化授权。
国际药讯
1.阿斯利康凝血药完成IV期临床。阿斯利康宣布凝血因子Xa抑制剂逆转剂Andexxa(anddexanet alfa)在上市后IV期试验(ANNEXA-I)中达到止血优效性标准。该项试验旨在评估Andexxa在接受口服FXa抑制剂治疗(包括阿哌沙班和利伐沙班)、出现因危及生命或出血失控而需要逆转抗凝治疗的患者中的效果。独立数据和安全监测委员会评估的中期数据显示,Andexxa的止血效果比预期要早。目前,阿斯利康已提前终止该项研究。
2.O药治疗霍奇金淋巴瘤Ⅲ期临床积极。百时美施贵宝PD-1抑制剂Opdivo(nivolumab)在ASCO2023年会上公布一线治疗晚期经典型霍奇金淋巴瘤的Ⅲ期试验SWOG S1826积极结果。数据显示,Opdivo治疗与活性对照药物Adcetris相比,显著降低患者癌症进展或死亡风险达52%;两组患者一年内没有发生病情进展的患者比例分别为94%和86%(单侧p值=0.0005)。两组3级中性粒细胞减少症的发生率分别为48%和30%。
3.施维雅IDH1/2抑制剂胶质瘤Ⅲ期临床积极。施维雅潜在“first-in-class”IDH1/2抑制剂vorasidenib单药治疗残留或复发IDH突变低级别胶质瘤患者的Ⅲ期临床达到主要终点。与安慰剂相比,vorasidenib显著提高患者无进展生存期(中位PFS:27.7个月vs11.1个月,HR=0.39;单边P=0.000000067)。目前,vorasidenib的中位TTNI(下一次干预时间)尚未达到,安慰剂组为17.8个月(HR=0.26;单边P=0.000000019)。目前,该新药的上市申请已获得FDA授予快速通道资格。
4.杨森FGFR抑制剂膀胱癌Ⅲ期临床积极。杨森FGFR激酶抑制剂Balversa(erdafitinib)治疗携带特定成纤维细胞生长因子受体(FGFR)基因突变的转移性或不可切除尿路上皮癌(UC)患者的Ⅲ期临床(THOR)达到主要终点。与化疗相比,Balversa显著提高患者的总生存期(OS:12.1个月vs7.8个月,p=0.0050),将死亡风险降低36%。两组患者中位无进展生存期分别为5.6个月和2.7个月(HR=0.58;p=0.0002)。独立数据安全监测委员会建议提前停止试验。
5.NASH创新组合疗法Ⅱb期试验积极。Akero公司Fc-FGF21融合蛋白efruxifermin(EFX)联合GLP-1受体激动剂治疗非酒精性脂肪性肝炎(NASH)的Ⅱb期SYMMETRY临床扩展队列(N=31,队列D)结果达到主要终点和次要终点。与单独GLP-1治疗相比,EFX联合治疗12周时患者肝脏脂肪较基线减幅更大(65%vs10%);达到肝脏脂肪正常化的患者比例显著更高(88%vs10%)。药物的总体耐受性良好,与之前试验结果相似。
6.Moderna个体化癌症疫苗IIb期临床积极。Modernay与默沙东开发的癌症疫苗mRNA-4157 (V940)在ASCO2023年会上公布与PD-1疗法Keytruda联合辅助治疗完全切除的III/IV期黑色素瘤患者的IIb期临床KEYNOTE-942/mRNA-4157-P201最新结果。与单独Keytruda相比,mRNA-4157联合辅助治疗显著改善总意向治疗(ITT)人群的无远处转移生存期(DMFS),使肿瘤产生远处转移或死亡的风险降低65%(HR=0.347,95% CI:0.145-0.828];单侧P值=0.0063)。该新药此前已分别获得FDA和EMA授予的突破性疗法认定和优先药物资格。
医药热点
1.河南开展家庭病床服务试点。河南省卫健委近日联合印发《开展家庭病床服务试点工作方案》指出,选择郑州市、开封市、洛阳市、许昌市及周口市作为家庭病床服务省级试点,其他省辖市选择1~2个县(市、区)作为市级试点,并于6月底前全面启动试点任务。根据《方案》,对于家庭病床服务,河南新增“上门服务费”项目,完善“家庭病床建床费”项目内涵,明确规范收费标准。针对医保支付政策,河南推进家庭病床支付方式改革,各统筹地区可根据疾病诊疗特点,将家庭病床纳入按床日收费、按病种付费或按人头付费。
2.邓华亮任山东中医药大学附属医院院长。6月1日下午,山东中医药大学附属医院(山东省中医院)召开干部会议,宣布中共山东省委决定,任命邓华亮同志为山东中医药大学附属医院院长。邓华亮,中医学博士后,医学博士,教授,主任医师,曾任山东省中医院副院长。目前兼任山东省患者安全管理协会副会长、全国中医药高等教育学会临床教育研究会副会长、世界中医药学会联合会医疗机构管理专业委员会副会长、中华中医药学会中医诊断专业委员会委员等学术职务。
3.Science子刊:睡眠不足会促进老年痴呆。近日,圣路易斯华盛顿大学医学院的研究人员在 Science 子刊 Science Translational Medicine 上发表的最新研究论文显示,与正常睡眠模式的5xFAD阿尔茨海默病小鼠模型相比,睡眠剥夺不仅增强了TREM2依赖性的Aβ斑块沉积,而且还诱导了不依赖于实质性Aβ斑块存在的小胶质细胞反应。这一发现有助于解释长期观察到的睡眠不足与神经变性之间的联系。
评审动态
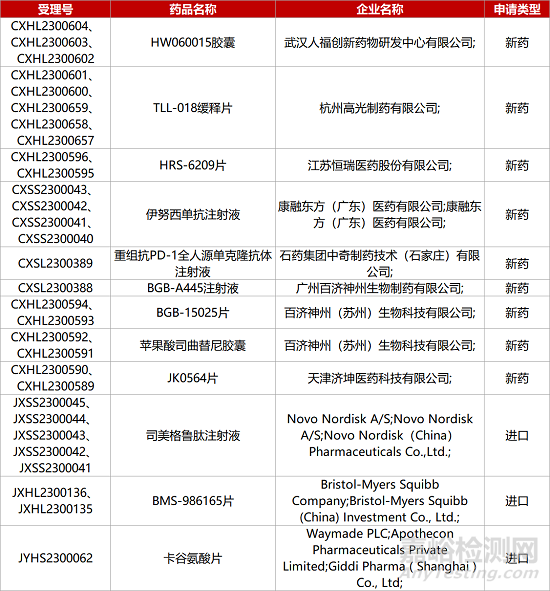
1. CDE新药受理情况(06月03日)
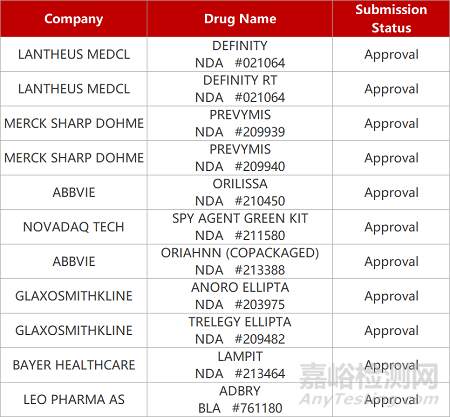
2. FDA新药获批情况(北美06月05日)