一、概述
自 2014年5月30日国监局发布《医疗器械产品技术要求编写指导原则》,及2014年6月1日新修订的《医疗器械监督管理条例》颁布实施后,“产品技术要求”替代“注册产品标准”,明确了产品技术要求的法律地位,同时,医疗器械产品备案或注册均需提交产品技术要求文件尤其是在注册技术审查过程中,产品技术要求是医疗器械技术审评机构进行技术审查时的重要关注点。产品技术要求是否符合适用的强制性标准要求,性能指标的合理性,检验方法的可重复性和可操作性、以及注册临床评价对比产品性能要求是否等同等均是技术审查重点审评的内容。
二、附录A中主要安全特征内容
有源医疗器械产品技术要求附录A中的内容是医疗器械注册时审评中心关注的一个重点内容,同时也是使产品符合标准的要求。
根据 GB9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》和 YY9706.102-2021《医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准: 电磁兼容要求和试验》,技术要求附录 A 中主要安全特征内容如下图所示:
三、常见附录 A主要安全特征内容分析
1.按防电击类型分类:
根据 GB 9706.1-2020 第5.1条:按照防电击的类型分类可以分为以下几类:
1)I类设备: 具备保护接地,通俗的讲,电源线为三个插脚(含地线)
2)II类设备:电源线为两个插脚(不含地线)(注意:使用功能接地的I 类设备也可能电源线为3个插头)
3)内部电源设备:电源置于设备内部,提供设备工作所需电能的设备
4)具有网源连接装置的双重组合分类,如具有网电源连接装置的内部电源设备(也可其他类型组合,如: I类内部电源类设备)
2.按防电击的程度分类:
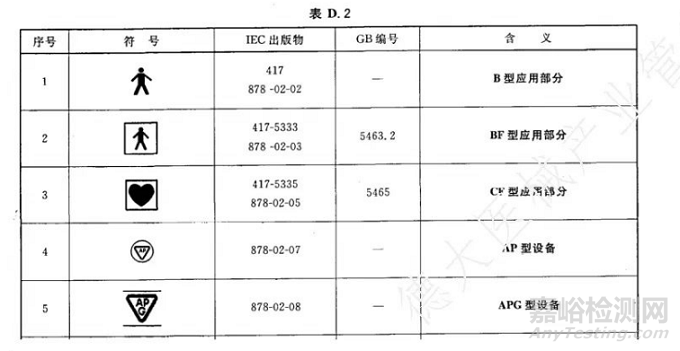
根据GB 9706.1-2020第 5.2条:按防电击的程度可以分为以下几类:
1)B型应用部分:对电击有特定防护程度的设备,符合本标准要求,尤其是漏电流容许值要求,也就是只要带应用部分最低就要是B型
2)F型应用部分:与设备其他部分相隔离的应用部分,其绝缘达到,当来自外部的非预期电压与患者相连,并因此施加于应用部分与地之间时,流过其间的电流不超过单一故障状态时患者漏电流的容许值
3)BF型应用部分:有 F型应用部分的型设备,对电击的防护能力和漏电流容许值均不低于 B 型应用部分,而且应用部分应该与其他带电电路和大地进行 F型浮动隔离
4) CF 型应用部分: 直接用于心脏的设备或设备部件必须为 CF 型。CF 型和 BF型在结构上一致,但 CF 可以直接应用于心脏部位,BF 型却不能,CF 型的患者漏电流容许值为 BF型的 1/10
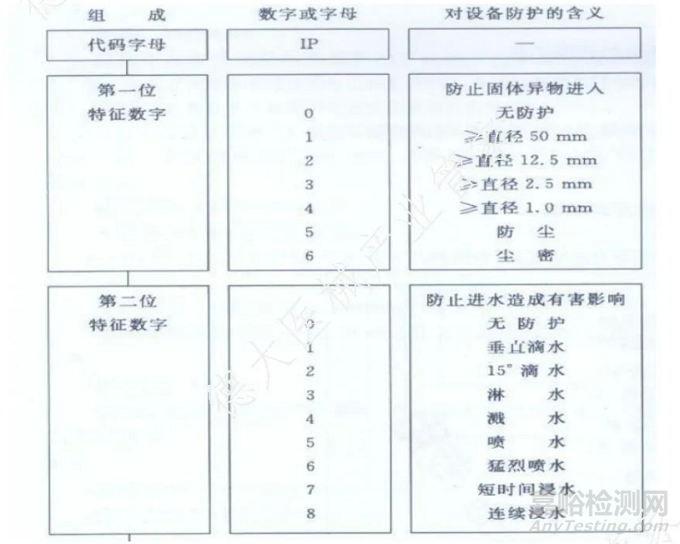
3.按对进液的防护程度进行分类:根据 GB/T 4208-2017 外壳对有害进液防护程度来区分可分为9个级别(如下图所示):
1) 防水等级书写:IPX5:略第一位特征数字(IP2X: 省略第二位特征数字,为仿固体异物进入)
2)不防水等级可以写为:IPX0
3)其他防水等级:由制造商自己根据实际设计情况进行声称,每个等级都有相对应的试验方法,检验方法详见 GB/T 4208-2017 的要求
4.按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气况下使用时的安全程度分类:
1)AP型:指在正常使用和正常状态下,设备、设备部件或元件必须不会点燃与空气混合的易燃麻醉气
2)APG 型:指在正常使用或单一故障状态时,设备、设备部件或元件必须不会点燃与氧或氧化亚氮混合的易燃麻醉气
3)非AP/APG型:不能在有易燃麻醉剂的情况使用
5.按运行模式分类:
按照 GB 9706.1-2020 进行注册的设备,按运行模式分类可以分为以下几种类型:
1)连续运行:额定负载下不超过规定温度限值
2)短时运行:从冷态启动,在规定周期内和额定负载条件下,工作温度不超过规定值的运行,各运行周期的间歇时间相当长,足以使设备冷却到冷态
3)间歇运行:比一系列规定的相同周期组成的运行状态,每一周期均包括一个温度极限不超过规定值的额定负载运行期和随后的设备空转或切断的间歇期
4)短时加载连续运行:设备一直和电网相连接运行,规定的容许加载时间很短,以至不会达到长时间负载运行的温度,而随后的间歇时间足够长,使设备冷却到长时间空载运行的温度
5)间歇加载连续运行:设备一直和电网相连接运行,规定的容许和加载时间很短,以致不会达到长时间负载运行的温度:而随后的间歇时间又不够长到使设备冷却到长时间空载运行的温度
6.设备的额定电压和频率
这部分填写的额定电压和频率应与产品的铭牌标签一致,主要有两种情况编写:
1) 无频率值:直流或者内部电源设各没有频率值,如内部电源:为 d.c.3.7V
2)有频率值:主要为交流电源设备,可写成:a.c.220V /50Hz
7.设备的输入功率
按产品铭牌上的功率信息滚写,额定输入必须以安培或伏安表示,当功率因数大
于 0.9 时也可用瓦表示,如: 100VA
8.设备是否具有对除颤放电效应防护的应用部分
如果应用部分有防除颤功能那么需要注明,否则直接写:无。
9.设备是否具有信号输出或输入部分
常见的信号输入/输出口如USB口、RS232口、网络LAN口等,按产品的实际情况编写,如果有信号输入/输出口时,注明“有”,如果没有信号输入/输出口时,注明“无”。
10.永久性安装设备或非永久性安装设备
1)永久性安装设备:设备的电源线直接与墙上电路系统连接,拆除需要使用工具时,不需再通过插头接入电源
2) 非永久性安装设备:通过插头接入电源的设备
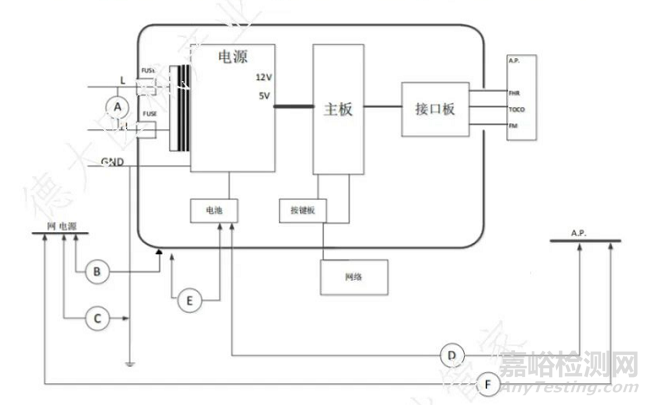
11.电气绝缘图
1) 电气绝缘图:电气绝缘图应标明产品设计的绝缘路径,如下图所示:
2) 电气绝缘参数表:应表格包含绝缘路径、绝缘类型、基准电压、试验电压爬电距离、电气间隙等内容,如下图所示:
12.电磁兼容 GB 4824-2019 分组根据GB 4824-2019的要求,医疗设备主要分为四组情况:
1)1组A类
2)2组A类
3)1组B类
4)2组B类
四、结语
有源医疗器械技术要求附录 A 是产品注册审评过程中关注的一个重点内容,同时该部分的内容也涉及到产品标识、安规和EMC测试的内容,如果技术要求附录A的内容与实际产品的要求不一致,可能会引起监管等的风险存在,所以,GB9706.1-2020《医用电气设备 第1部分、本安全和基本性能的通用要求》和 YY9706.102-2021《医用电气设备 第12部分: 基本安全和基本性能的通用要求 并列标准:电磁兼容要求和试验》标准明确的要求了附录A内容,也是规范产品技术要求符合法规的要求。