今日头条
首药控股RET抑制剂上肺癌Ⅲ期临床。首药控股RET抑制剂SY-5007片登记启动一项Ⅲ期临床,拟评价用于RET融合晚期非小细胞肺癌(NSCLC)患者的有效性和安全性。该试验主要研究者为上海市肺科医院主任医师周彩存教授。公布于ASCO2023年会上的Ⅰ期临床数据显示,SY-5007在晚期RET融合阳性NSCLC和RET突变甲状腺髓样癌(MTC)患者中的总缓解率(ORR)和疾病控制率(DCR)分别为62.0%和94.0%,而且药物的耐受性良好。
国内药讯
1.和黄医药VEGFR抑制剂拟纳入突破性治疗品种。和黄医药VEGFR抑制剂呋喹替尼胶囊获CDE拟纳入突破性治疗品种,针对的适应症为:联合抗PD-1单抗信迪利单抗注射液用于既往至少一线含铂治疗失败的错配修复完善(pMMR)晚期子宫内膜癌患者。2018年9月,该药已在中国获批用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者,包括既往接受过抗VEGF治疗或抗EGFR治疗(RAS野生型)的患者。
2.迪哲HER2 TKI乳腺癌早期临床积极。迪哲医药在Breast Cancer Research期刊上发表其高脑渗透性、HER2酪氨酸激酶抑制剂(TKI)DZD1516的临床前和国际Ⅰ期临床研究成果。共纳入23例来自中国和美国的HER2阳性转移性乳腺癌患者接受DZD1516单药治疗。结果显示,DZD1516在脑转移患者中的Kpuu,CSF(脑脊液与血浆中游离药物浓度的比值)为2.1;DZD1516在25mg-250mg每日两次给药剂量范围内耐受性良好。
3.智康弘义CDH3靶向ADC上Ⅰ期临床。智康弘义新一代靶向CDH3的抗体偶联药物BC3195在国内开展的Ⅰa/Ⅰb期临床完成首例受试者给药。这是BC3195首次人体临床,拟评估用于局部晚期或转移性实体瘤患者中的安全性、耐受性、药代动力学特征以及初步有效性。今年2月,该新药已在美国获得临床批件。智康弘义计划在中美同步开展BC3195用于治疗晚期实体瘤的Ⅰ期临床研究。
4.本导CRISPR抗病毒基因编辑疗法美国获批临床。本导基因开发的CRISPR抗病毒基因编辑药物BD111注射液获FDA批准,即将在美国开展用于Ⅰ型单纯疱疹病毒性基质型角膜炎治疗的临床研究。BD111利用本导基因原创性的新型基因治疗载体——类病毒体(VLP)转导CRISPR基因编辑工具直接靶向切割HSV-1的基因组,达到降低甚至清除HSV-1病毒基因组的目的,从而实现对疱疹病毒型角膜炎的治疗。今年5月,该新药已在国内获批临床。
5.信达HER2-ADC获批实体瘤临床。信达生物HER2 ADC新药IBI354获国家药监局临床试验默示许可,拟开发用于晚期实体瘤的治疗。去年年底,信达生物在ClinicalTrials.gov网站上登记注册一项IBI354的I/II期单臂临床试验(NCT05636215)。该项研究计划在澳大利亚开展,拟招募444例晚期实体瘤患者,预估的研究开始时间为2023年1月,目前的状态为尚未招募,并预计将于2024年10月初步完成。
6.赛诺菲GPC3/TCR纳米抗体中国获批临床。赛诺菲1类生物制品注射用SAR444200获国家药监局临床许可,拟开发治疗GPC3阳性晚期实体瘤。SAR444200是一款抗GPC3/TCR纳米抗体(VHH),正在首次人体Ⅰ/Ⅱ期剂量递增和扩展研究中,评估单药治疗或与其他抗癌药物联合用药用于既往治疗过转移性恶性肿瘤的受试者的治疗潜力。GPC3(Glypican-3)是细胞膜表面的硫酸乙酰肝素糖蛋白,在肝癌组织中高度表达。
国际药讯
1.渤健SMA新药长期疗效见刊。渤健在《Muscle & Nerve》期刊发表脊髓性肌萎缩症(SMA)药物诺西那生钠注射液用于症状前SMA患儿(经基因诊断)治疗的Ⅱ期开放标签研究NURTURE的最新积极数据。此前5年治疗数据已显示,所有25例受试患儿100%均存活,能够保持并达成新的运动里程碑。经过两年的额外随访,所有患儿均存活,且无需永久性通气辅助,其中23人能够独立行走(大多数在正常年龄段达到)。在延长的随访期内,药物的安全性与之前研究一致。
2.礼来非共价BTK抑制剂早期临床见刊。礼来旗下Loxo Oncology在《新英格兰医学杂志》上发表非共价选择性布鲁顿氏激酶(BTK)抑制剂pirtobrutinib治疗BTK抑制剂经治的慢性淋巴细胞白血病(CLL)或小淋巴细胞性淋巴瘤(SLL)患者的Ⅰ/Ⅱ期试验BRUIN详细结果。pirtobrutinib在这类难治性患者中达到73.3%(95% CI:67.3-78.7)的缓解率,分别有1.6%与71.3%的患者达成完全与部分缓解。今年1月,该新药已获得FDA加速批准上市。
3.第四代EGFR-TKI早期临床积极。Black Diamond公司第四代EGFR抑制剂BDTX-1535在治疗EGFR突变非小细胞肺癌(NSCLC)的Ⅰ期临床获积极结果。结果显示,BDTX-1535在12例可评估患者中客观缓解率(ORR)达到50%,DCR为100%;药物最常见的药物相关不良事件是轻中度皮疹、腹泻、口腔炎、甲沟炎、恶心和疲劳。数据公布后,当天开盘后Black Diamond股价高开高走,最终收涨235%。
4.Sirnaomics投资拓展RNA编辑疗法。RNAi药物公司Sirnaomics宣布与一家专注于RNA编辑疗法的初创公司EDIRNA达成合作许可协议,对后者提供启动资金并向其独家授权RNA编辑应用的相关专利技术,以推进和优化其专有的Edit-to-Cure Therapeutics™递送平台,联合开发新型RNA编辑治疗药物。Sirnaomics凭借其专有的多肽纳米颗粒递送平台和第二代GalNAc偶联物递送平台,已建立丰富的候选药物管线(STP705、STP707和STP122G等)。
5.辉瑞投资诺奖得主通用型CAR-T公司。辉瑞日前以2500万美元的价格购买诺奖得主Jennifer Doudna教授创建的基因编辑公司Caribou Biosciences的股票,以投资该公司的一款通用BCMA CAR-T疗法CB-011。CB-011是一款CRISPR编辑的同种异体CAR-T细胞疗法,拟开发用于治疗复发性/难治性多发性骨髓瘤患者。临床前研究结果显示,CB-011在携带已建立原位植入多发性骨髓瘤细胞的小鼠中诱导长期存活。
6.通用型细胞疗法公司Tessa宣布破产。由于市场低迷,专攻实体瘤T细胞免疫疗法的Tessa公司日前宣布破产并进入清算程序。2022年6月,Tessa完成了1.26亿美元的A轮融资,并计划利用这笔资金推进公司自体CD30-CAR-T疗法TT11和同种异体CD30.CAREBVST疗法TT11X项目的临床进展。就在上个月,该公司公布TT11X治疗复发性或难治性(R/R)霍奇金淋巴瘤患者的最新临床积极数据,TT11X在18例既往经多线治疗的患者中达到78%的总缓解率(ORR)。
医药热点
1.首个眼科罕见病诊治中心在沪揭牌。7月8日,国家眼科疾病临床医学研究中心罕见病诊治中心在上海市第一人民医院成立。这是全国首个眼科罕见病诊治中心,未来将启动不同种类遗传性视网膜疾病的基因治疗临床试验,填补我国眼科自主研发基因治疗药物领域的空白。目前,上海市第一人民医院眼科中心已建立了一整套符合国际规范和中国人群疾病特点的诊疗流程,并开发了全国首个多中心自然病程队列研究信息管理系统。
2.多家医院质子重离子中心在建。6月29日,国家卫健委网站发布“十四五”大型医用设备配置规划明确“十四五”期间,用于恶性肿瘤等治疗的重离子质子放射治疗系统将在31个省配置共41台。据中华医学会放射肿瘤治疗学分会副主委、中国医学装备协会离子放疗分会首任会长、中山大学附属肿瘤医院放疗科主任陈明介绍,我国已有天津市肿瘤医院、河北一洲肿瘤医院、吉林省肿瘤医院、上海交通大学医学院附属瑞金医院、安徽省立医院等16家医院获得质子装置配置证,目前,实际在建的质子项目有近30个。
3.施一公团队最新研究成果见刊。近日,清华大学/西湖大学施一公团队在期刊《Life Science Alliance》上发表题为“Structural insights into CED-3 activation”的研究论文,该研究组装了不同的CED-4/CED-3复合物来模拟CED-3的顺序激活阶段,并确定了它们的冷冻电镜结构。除了先前报道的晶体结构中的八聚体外,CED-4单独或与CED-3复合物以多种寡聚态存在。在生化分析的支持下,该研究发现保守的CARD-CARD相互作用促进了CED-3的激活,并且程序性细胞死亡的启动受到CED-4凋亡的动态组织的调节。
评审动态
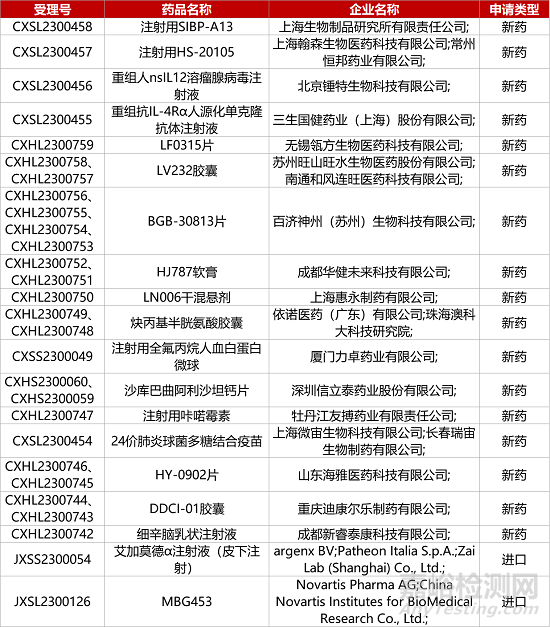
1. CDE新药受理情况(07月09日)
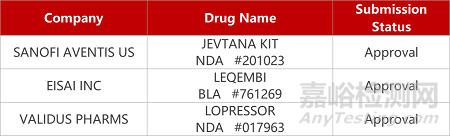
2. FDA新药获批情况(北美07月07日)