您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-07-17 09:16
|
条款 |
要求 |
|
247 |
各部门负责人应当确保所有人员正确执行生产工艺、质量标准、 检验方法和操作规程,防止偏差的产生 |
|
248 |
企业应当建立偏差处理的操作规程,规定偏差的报告、记录、调 查、处理以及所采取的纠正措施,并有相应的记录。 |
|
249 |
何偏差都应当评估其对产品质量的潜在影响。企业可以根据偏 差的性质、范围、对产品质量潜在影响的程度将偏差分类(如重大、次要偏差),对重大偏差的评估还应当考虑是否需要对产品进行额外的检验以及对产品有效期的影响,必要时,应当对涉及重大偏差的产品进行稳定性考察 |
|
250 |
何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规 程等的情况均应当有记录,并立即报告主管人员及质量管理部门,应当有清楚的说明,重大偏差应当由质量管理部门会同其他部门进行彻底调查,并有调查报告。偏差调查报告应当由质量管理部门的指定人员审核并签字。企业还应当采取预防措施有效防止类似偏差的再次发生。 |
|
251 |
量管理部门应当负责偏差的分类,保存偏差调查、处理的文件 和记录 |
|
252 |
业应当建立纠正措施和预防措施系统,对投诉、召回、偏差、 自检或外部检查结果、工艺性能和质量监测趋势等进行调查并采取纠正和预防措施。调 查的深度和形式应当与风险的级别相适应。纠正措施和预防措施系统应当能够增进对产 品和工艺的理解,改进产品和工艺 |
|
253 |
企业应当建立实施纠正和预防措施的操作规程,内容至少包括: (一)对投诉、召回、偏差、自检或外部检查结果、工艺性能和质量监测趋势以及其他来源的质量数据进行分析,确定已有和潜在的质量问题。必要时,应当采用适当的统计学方法; (二)调查与产品、工艺和质量保证系统有关的原因; (三)确定所需采取的纠正和预防措施,防止问题的再次发生; (四)评估纠正和预防措施的合理性、有效性和充分性; (五)对实施纠正和预防措施过程中所有发生的变更应当予以记录; (六)确保相关信息已传递到质量受权人和预防问题再次发生的直接负责人; (七)确保相关信息及其纠正和预防措施已通过高层管理人员的评审。 |
|
254 |
施纠正和预防措施应当有文件记录,并由质量管理部门保存。 |
|
偏差/事件开启 |
|
|
偏差或事件 |
□偏差 □事件 |
|
发现部门 |
|
|
发现事件和日期 |
|
|
发现地点 |
|
|
发生时间和日期 |
|
|
发生地点 |
|
|
通知QA的日期/时间 |
|
|
偏差/事件的客观描述包括涉及到的产品、批次、设备编号,所违背的SOP规定等 2015.04.23 11:36 实验员汪某在做A1原液(批号为:A1201504018B-A1201504023B)卵清蛋白含量测定(酶联法)时,内部标准品结果为12.0ng/m,公司内部SOP规定的内部标准品7.5ng/ml计算结果应在5-10ng/ml之间,不符合SOP规本次实验无效。 |
|
|
立即采取的紧急措施(如有) 见第2步 |
|
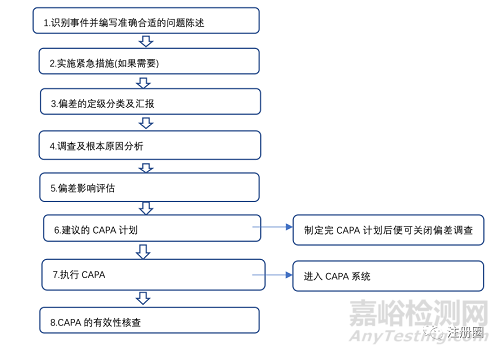
2.实施紧急措施(如果需要)
|
偏差级别 |
定义 |
|
Critical deviation(关键偏差) |
对已上市的产品安全、鉴别、规格、质量、纯度、效力、性能、可靠性、药效持续时间等有潜在负面影响的偏差,或对临床研究有潜在负面影响的偏差,或导致一个质量系统重大失败的偏差。 |
|
Major deviation(主要偏差) |
对未上市或者用于临床研究的产品安全性、鉴别、规格、质量、纯度、效力、性能、可靠性、药效持续时间等有一定影响的潜在的负面影响的偏差。这类偏差显示的系统性失败影响有限,或偏差在现有程序检查时发现并可能再次发生。 |
|
Minor deviation(微小偏差) |
对产品安全、鉴别、规格、质量、纯度、效力、性能、可靠性、药效持续时间等没有或者只有很小的负面影响的偏差,同时不偏离法规要求或者承诺。 |
附件A中提供了偏差定级的具体举例。
|
偏差/事件编号 |
到期日期 |
||||||||||||||||||||||||||||||||
|
偏差/事件名称
|
|||||||||||||||||||||||||||||||||
|
偏差调查信息 |
|||||||||||||||||||||||||||||||||
|
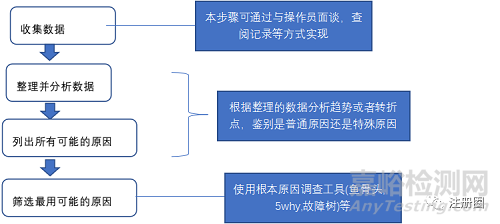
(1)对实验员的调查 通过与实验员面谈,确认实验过程中样品加样顺序及额外等待时间与检测SOP及试剂盒说明书不完全一致,但是这两处的不一致并不影响产品检测结果,因此不会影响内参结果,并不是偏差的根本原因。同时实验员指出,卵清蛋白含量检测标准曲线的相关系数R2比较低,通常仅有0.95左右,具体见下表:
通过进一步查看卵清蛋白含量检测过程中的标准曲线,发现该曲线并不是并不是标准的一阶回归曲线,而是类似与抛物线的曲线,见下图:
(2)对试剂盒供应商及gsk的咨询 通过对试剂盒供应商的咨询,厂家建议选择四元回归曲线。但目前公司QC的酶标仪不具备此功能。查阅gsk意大利工厂的卵清含量检测Sop发现,意大利工厂采用二阶回归曲线来作为标准曲线,即Y=aX2+bX+C,其中a,b,c为常数,Y为卵清蛋白,X为对应的吸光度。同天咨询公司的数理统计专家得到如下反馈:四参数模型可以使用较大范围的ELISA实验,例如卵清蛋白含量范围从1ng/ml到1ug/ml范围,由于胡可效应,标准曲线呈现随待测样品浓度增加而吸光度增加幅度越来越小。如下图:
但在待测样品浓度范围较小时,可以使用一阶回归或者二阶回归来你和标准曲线,只要其方法误差在允许范围内即可。 卵清蛋白含量检测分析方法标准曲线类型的确定:公司之前使用一阶线性回归曲线作为标准曲线,只要其方法误差在可接受范围内,方法就并非错误。内参作为实验有效性的判断工具,其真实含量为7.5ng/ml,可接受标准为5-10ng/ml,即标准的回收率为66.7%-133.3%。根据《分析方法验证管理规程》,对于生物学检验,其准确性需要通过数据统计分析确定,因为该类方法不如仪器分析方法那样具有重复性。该管理规程同时给出仪器分析方法在被分析物不同浓度时建议的标准回收率范围,仪器分析方对于卵清蛋白含量检测方法,标准回收率为66.7%-133.3%是可接受的。 对比相同一次检测中使用一阶回归与二阶回归你和标准曲线,得到下图:
由图可看出,二阶回归曲线的标准品浓度X‘要比一阶线性回归得到的X要小,而对比表1中的内参数据,可以看出公司卵清蛋白含量检测中过内参结果绝大多数均接近标准上线,即内参检测结果偏高。如果可以将标准曲线由以及回归改为二阶回归,即可防止出现由于内参大于标准上限导致的实验无效。
使用卵清蛋白含量检测试剂盒中一组标准品及内参数据,使用公司的以及回归方法以及意大利工厂二阶段回归方法分别计算内参结果。见下表:
由表可以看出,使用二阶回归标准曲线R2可以达到0.999以上,表明该标准曲线更能代表数据的分布方式。同时内参与厂家给出的真实值更加接近。因此可以得出结论,使用二阶回归标准曲线更加准确。 |
|||||||||||||||||||||||||||||||||
|
根本原因分析 通过以上的调查分析,可以确定,本偏差发生的根本原因是:卵清蛋白含量检测方法使用一阶回归曲线作为标注曲线,但该方法二阶回归做标准曲线更加准确,即标准曲线不充分。 |
|||||||||||||||||||||||||||||||||
|
调查组长/日期 |
|||||||||||||||||||||||||||||||||
|
QA评估组长/日期 |
|||||||||||||||||||||||||||||||||
|
生产负责人/日期 |
|||||||||||||||||||||||||||||||||
|
质量负责人/日期 |
|||||||||||||||||||||||||||||||||
5.偏差影响评估
|
偏差/事件编号 |
到期日期 |
||||||||
|
偏差/事件名称 |
|||||||||
|
调查评估 |
|||||||||
|
调查主导部门 |
|||||||||
|
确认偏差/事件描述 充分□ 不充分□ |
|||||||||
|
是否符合国家法规或公司执照、证书要求 |
是□ 否□ |
||||||||
|
1.产品影响评估 |
有影响或潜在影响□ 无影响□ |
||||||||
|
所用潜在受影响的物料、产品等
产品影响的理由: 由于内参不合格电子计算表格回自动生成实验室不成立的”Fail”,标志,并拒绝计算样品含量结果,实验员对于涉及的6批原液的卵清蛋白重新进行了检测。因此本偏差内参不合格不会对检测结果造成影响。 |
|||||||||
|
2.对质量管理体系的影响 |
|||||||||
|
偏差/事件对继续生产、验证等其他系统的影响,若无影响请说明理由: 本偏差发生在QC实验室,不涉及生产工艺,验证等系统无影响,对产品稳定性考察亦没有影响,故对质量管理体系无不良影响。 |
|||||||||
|
调查组长/日期 |
|||||||||
|
QA评估组长/日期 |
|||||||||
|
生产负责人/日期 |
|||||||||
|
质量负责人/日期 |
|||||||||
偏差的两个重要指标:偏差调査处理的及时性是偏差系统能否有效运作的关键因素之一,偏差报告时限以及偏差调査和处理时限是衡量偏差调査处理的及时性的两个关键指标。
|
CAPA编号 |
||||
|
CAPA名称 |
||||
|
问题或潜在风险来源 □偏差(偏差编号:_________) □事件(偏差编号:_________) □召回 □CAPA(CAPA编号______) □变更(变更编号:_________) □客户投诉(编号_________) □产品年度回顾 □自检 □外部审计 □工艺性能和产品质量检测趋势 □风险评估 □其他_____________ |
||||
|
□属于法规承诺 □不属于法规承若 |
||||
|
纠正预防措施CAPA |
||||
|
CAPA行动 |
计划完成日期 |
负责人 |
||
|
更改卵清蛋白含量检测SOP,即将标准曲线由一阶改为二阶回归 |
xxxx |
xxx |
||
(来源于critical的偏差,投诉、法规承诺和检查关键缺陷的CAPA必须进行有效性核查)如不需要有效性核查请说明理由 QC部门发起变更申请,变更后在下一批次的检查测中使用变更后的方法,由于该方法在调查阶段已经过充分的评估和测试,因此后续不需要进行有效性核查。 |
||||
|
CAPA开启人/日期 |
||||
|
CAPA所用人/日期 |
||||
|
QA批准人/日期 |
||||
|
CAPA编号 |
计划完成时间 |
|||||||||||||||||
|
CAPA名称 |
||||||||||||||||||
|
CAPA的执行情况 □CAPA行动未全部完成 □CAPA行动已全部完成,对应的企业内部文件编号或证明性资料(附件清单,包括编号、名称等)
□申请CAPA关闭 □CAP还需进行有效性核查
CAPA所有人/日期 |
||||||||||||||||||
|
□记录完整、符合SOP要求 □记录不完整、不符合SOP要求
CAPA文控专员/日期 |
||||||||||||||||||
|
□同意关闭 □不同意关闭(说明理由)
QA批准人/日期 |
||||||||||||||||||
8.CAPA的有效性核查
|
CAPA编号 |
计划完成时间 |
|||
|
CAPA名称 |
||||
|
有效性核查通过的要求 |
||||
|
有效性核查结果 |
□通过 □失败 |
|||
|
□CAPA行动完成后规定的时间内是否不再发生类似的问题
□CAPA行动是否对其他工艺产生不良影响
|
||||
|
□申请CAPA关闭
□CAPA还需要采取进一步行动(如有,请给出comments)
|
||||
|
CAPA所有人/日期 |
||||
|
□记录完整、符合SOP要求
□记录不完整、不符合SOP要求
CAPA文控专员/日期 |
||||
|
□同意关闭
□不同意关闭(说明理由)
QA批准人/日期 |
||||
|
Critical(关键偏差):满足以下任何一条即可定级为critical |
|
1.对以上是产品或用于临床的产品安全、特性、规格、纯度、效价、存在不利的影响偏差 |
|
2.质量系统重大缺陷或偶然机会识别的重大缺陷 |
|
3.可能导致病人处于污染风险 |
|
4.无菌测试失败,包括培养基灌装试验 |
|
5.在确认过程中,某项程序不符合可接受标准 |
|
6.在标示的储存条件下,产品在有效期内稳定性不合格 |
|
7.故意违背GMP(例如:伪造数据) |
|
8.病毒或细菌灭活失败 |
|
9.产品混批和标签错误(错误的产品名称和规格) |
|
10.确认用于生产、检测、和控制产品、设备、方法的验证或者在验证不合格 |
|
11.违背许可放行 |
|
Major: 满足以下任何一条即可定级为major |
|
1.物料不符合披肩要求或特定的法规要求,且没有放行的 |
|
2.不符合注册的标准(如:中间过程控制或最终产品质量)且没有放行的物料 |
|
3.工序微生物超行动线 |
|
4.生产期间A或B级环境结果超标 |
|
5.影响产品的注射用水或纯化水结果超标 |
|
6.客户技术性投诉的趋势 |
|
7.中间过程参数控制不符合要求(例如:温度、压力、收率) |
|
8.中间过程质量不符合标准(例如:pH、蛋白质、效力、杂质) |
|
9.设别清洁失败 |
|
10.清洁程序执行不符合要求 |
|
11.OOS |
|
12.使用过期的培养基、试剂、缓冲液等 |
|
13.GMP记录丢失(举例:批记录,测试结果表) |
|
14.使用AQL检查表对包装产品进行检查是,结果超标 |
|
15.成品、半成品、原辅料储存温度超标 |
|
16.原辅料或称产品组分已经放行,但发现问题(如:生产时发现原辅料中有颗粒) |
|
Minor微小偏差 |
|
1.C,D级环境结果超标,且不影响产品 |
|
2.由于疏忽违背SOP,且不影响产品 |
|
3.记录文件错误,且不影响产品 |
|
4.不影响工序或产品的设备故障 |
|
5.储存温度超温且不影响产品 |
▲ 表1-偏差调查开启
|
偏差/事件开启 |
|
|
偏差或事件 |
□偏差 □事件 |
|
发现部门 |
|
|
发现事件和日期 |
|
|
发现地点 |
|
|
发生时间和日期 |
|
|
发生地点 |
|
|
通知QA的日期/时间 |
|
|
偏差/事件的客观描述包括涉及到的产品、批次、设备编号,所违背的SOP规定等
|
|
|
立即采取的紧急措施(如有)
|
|
|
偏差/事件编号 |
到期日期 |
|
偏差/事件名称
|
|
|
偏差调查信息 |
|
|
根本原因分析
|
|
|
调查组长/日期 |
|
|
QA评估组长/日期 |
|
|
生产负责人/日期 |
|
|
质量负责人/日期 |
|
|
偏差/事件编号 |
到期日期 |
||||||||
|
偏差/事件名称 |
|||||||||
|
调查评估 |
|||||||||
|
调查主导部门 |
|||||||||
|
确认偏差/事件描述 充分□ 不充分□ |
|||||||||
|
是否符合国家法规或公司执照、证书要求 |
是□ 否□ |
||||||||
|
1.产品影响评估 |
有影响或潜在影响□ 无影响□ |
||||||||
|
所用潜在受影响的物料、产品等
产品影响的理由:
|
|||||||||
|
2.对质量管理体系的影响 |
|||||||||
|
偏差/事件对继续生产、验证等其他系统的影响,若无影响请说明理由:
|
|||||||||
|
调查组长/日期 |
|||||||||
|
QA评估组长/日期 |
|||||||||
|
生产负责人/日期 |
|||||||||
|
质量负责人/日期 |
|||||||||
|
CAPA编号 |
||||
|
CAPA名称 |
||||
|
问题或潜在风险来源 □偏差(偏差编号:_________) □事件(偏差编号:_________) □召回 □CAPA(CAPA编号______) □变更(变更编号:_________) □客户投诉(编号_________) □产品年度回顾 □自检 □外部审计 □工艺性能和产品质量检测趋势 □风险评估 □其他_____________ |
||||
|
□属于法规承诺 □不属于法规承若 |
||||
|
纠正预防措施CAPA |
||||
|
CAPA行动 |
计划完成日期 |
负责人 |
||
|
R不需要有效性核查 □需要有效性核查 (来源于critical的偏差,投诉、法规承诺和检查关键缺陷的CAPA必须进行有效性核查)如不需要有效性核查请说明理由
|
||||
|
CAPA开启人/日期 |
||||
|
CAPA所用人/日期 |
||||
|
QA批准人/日期 |
||||
|
|
|
|||||||||||||||||
|
|
||||||||||||||||||
|
||||||||||||||||||
|
|
||||||||||||||||||
|
|
||||||||||||||||||
|
CAPA编号 |
计划完成时间 |
|||
|
CAPA名称 |
||||
|
有效性核查通过的要求 |
||||
|
有效性核查结果 |
□通过 □失败 |
|||
|
□CAPA行动完成后规定的时间内是否不再发生类似的问题
□CAPA行动是否对其他工艺产生不良影响
|
||||
|
□申请CAPA关闭 □CAPA还需要采取进一步行动 |
||||
|
CAPA所有人/日期 |
||||
|
□记录完整、符合SOP要求 □记录不完整、不符合SOP要求
CAPA文控专员/日期 |
||||
|
□同意关闭 □不同意关闭(说明理由)
QA批准人/日期 |
||||

来源:注册圈


